
科目: 来源:不详 题型:填空题
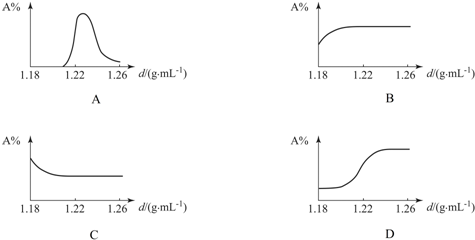
| 海水密度/(g?mL-1) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
查看答案和解析>>
科目: 来源:不详 题型:填空题

查看答案和解析>>
科目: 来源:不详 题型:问答题
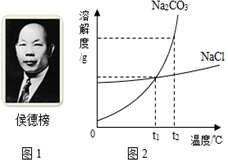
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.海底蕴藏着丰富能源,所以不用担心未来能源问题 |
| B.通过淡化海水可得到充足淡水,所以“节约用水”的理念过时了 |
| C.利用多次蒸发结晶法可除去粗盐中的可溶性杂质 |
| D.随意弃置旧金属,既造成环境污染,又浪费有限的金属资源 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
| 石灰乳 |
| 步骤Ⅰ |
| 稀盐酸 |
| 步骤Ⅱ |
| 电解 |
| 步骤Ⅲ |

查看答案和解析>>
科目: 来源:不详 题型:问答题
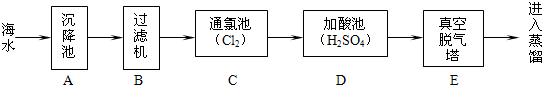
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 1 |
| 3 |


查看答案和解析>>
科目: 来源:不详 题型:问答题
| 1 |
| 4 |

| 第一次 | 第二次 | 第三次 | |
| 所取样品的质量/g | 9 | 9 | 18 |
| 所用硫酸溶液质量/g | 60 | 80 | 50 |
| 生成氢气的质量/g | 0.6 | 0.6 | 0.6 |
查看答案和解析>>
科目: 来源:不详 题型:填空题

查看答案和解析>>
科目: 来源:不详 题型:问答题

| 实验序号 | 第一次实验 | 第二次实验 | 第三次实验 |
| 所取海水质量/kg | 100 | 100 | 100 |
| 生成沉淀质量/kg | 0.28 | 0.29 | 0.30 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com