
科目: 来源:不详 题型:问答题

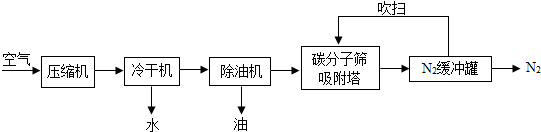
查看答案和解析>>
科目: 来源:不详 题型:问答题

查看答案和解析>>
科目: 来源:不详 题型:填空题




查看答案和解析>>
科目: 来源:不详 题型:单选题

| A.分离器中分离出的副产品是硫酸500℃ | ||||
| B.生产流程中能被循环利用的物质X为I2 | ||||
C.膜反应器中HI气体发生反应的化学方程式为2HX
| ||||
| D.该生产过程不仅能开发出氢能源,而且能实现可持续发展,不需再消耗能源 |
查看答案和解析>>
科目: 来源:不详 题型:填空题

| ||
| ||
| ||
查看答案和解析>>
科目: 来源:不详 题型:多选题

| A.沉淀池中的反应物共含有六种元素 |
| B.过滤得到的“母液”中一定只含有两种溶质 |
| C.图中X可能是氨气 |
| D.通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| ||
| 加压 |
| A.为CO2的利用创造了一种新途径 |
| B.钌-磷铬合物的质量在反应前后发生了变化 |
| C.氢原子数在反应前后发生了改变 |
| D.属于置换反应 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
 转化,都能一步完成的是( )
转化,都能一步完成的是( )| A | B | C | D | |
| X | C | Na2O | CaO | Fe |
| Y | CO2 | NaOH | CaCl2 | Fe2O3 |
| Z | Na2CO3 | NaCl | CaCO3 | Fe(OH)3 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目: 来源:不详 题型:问答题
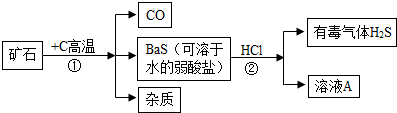
查看答案和解析>>
科目: 来源:不详 题型:问答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com