
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
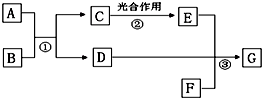
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 MgO+Cu.为探究该反应并采用热还原法制取金属铜,他在老师的指导下进行如下实验:将镁粉和氧化铜按一定比例充分混合,隔绝空气加热一段时间后,得到固体M.请你与小辉同学一起对该固体M进行探究.(资料:常温下,镁不与水发生反应;)
MgO+Cu.为探究该反应并采用热还原法制取金属铜,他在老师的指导下进行如下实验:将镁粉和氧化铜按一定比例充分混合,隔绝空气加热一段时间后,得到固体M.请你与小辉同学一起对该固体M进行探究.(资料:常温下,镁不与水发生反应;)
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 地 区 | 风景区 | 居民区 | 工厂区 |
| S02的浓度限值( mg/L) | 0.O0015 | 0.O0050 | 0.O0070 |

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com