
科目: 来源: 题型:
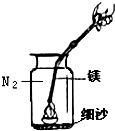 林林做镁带在空气中燃烧实验时,发现生成的白色固体的质量小于参加反应的金属镁和氧气的质量和.他在一本参考书上发现,镁居然能在氮气中燃烧!于是他做起了这个实验:将镁条点燃后迅速伸入盛有氮气的集气瓶中,发现镁条剧烈燃烧,发出白光,放热,产生一种叫氮化镁(Mg3N2)的粉末.
林林做镁带在空气中燃烧实验时,发现生成的白色固体的质量小于参加反应的金属镁和氧气的质量和.他在一本参考书上发现,镁居然能在氮气中燃烧!于是他做起了这个实验:将镁条点燃后迅速伸入盛有氮气的集气瓶中,发现镁条剧烈燃烧,发出白光,放热,产生一种叫氮化镁(Mg3N2)的粉末.查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:

| 物质 | 氧气 | 硫磺 | 二氧化碳 | 黄金 | 高锰酸钾 | 氦气 | 氯酸钾 |
| 化学符号 | O2 | S | CO2 | Au | KMnO4 | He | KClO3 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| ||
查看答案和解析>>
科目: 来源: 题型:
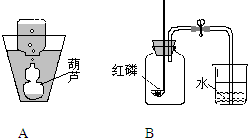 空腔果实内由于不发生光合作用,其中的气体可能与空气产生差异,某同学选择一个熟透的葫芦,按下列方案进行研究:
空腔果实内由于不发生光合作用,其中的气体可能与空气产生差异,某同学选择一个熟透的葫芦,按下列方案进行研究:查看答案和解析>>
科目: 来源: 题型:
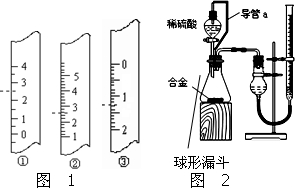 铝镁合金已成为飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.
铝镁合金已成为飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com