
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
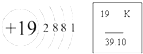 如图是某原子的结构示意图和它在元素周期表中的部分信息,该元素的名称是
如图是某原子的结构示意图和它在元素周期表中的部分信息,该元素的名称是查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
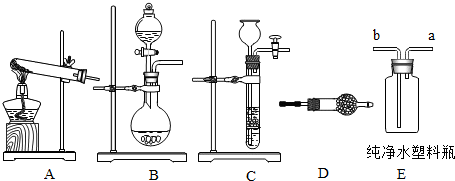
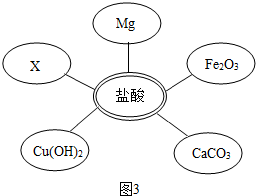
| 方案 | 加入试剂 | 分离方法 | 方案评价 |
| 方案一 | 适量Ca(NO3)2溶液 | 过滤、蒸发结晶 | 不可行,理由是 |
| 方案二 | 稍过量的 | 蒸发结晶 | 可行 |
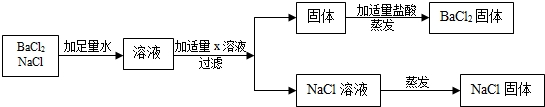
查看答案和解析>>
科目: 来源: 题型:
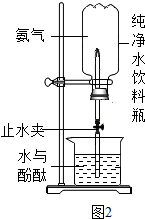
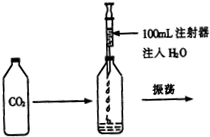 校化学课外小组的同学,利用塑料瓶(质软)设计了如图所示的实验.请你根据生活经验及所学的知识,结合实验回答下列问题:
校化学课外小组的同学,利用塑料瓶(质软)设计了如图所示的实验.请你根据生活经验及所学的知识,结合实验回答下列问题:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
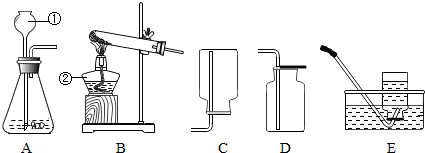
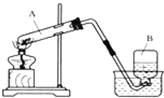 如图是实验室制取氧气的装置图.回答以下问题:
如图是实验室制取氧气的装置图.回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com