
科目: 来源: 题型:
| ||
查看答案和解析>>
科目: 来源: 题型:
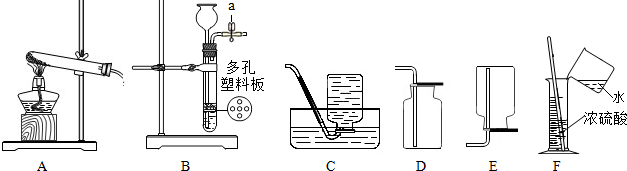
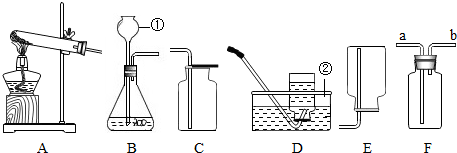
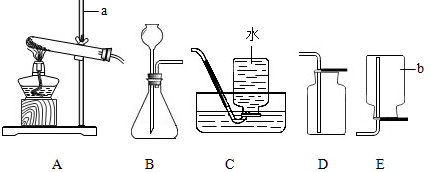
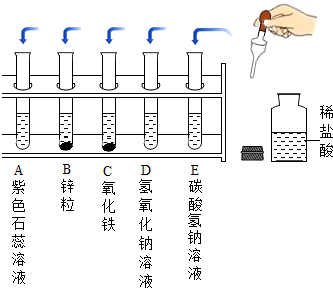 某化学实验小组探究稀盐酸的化学性质,取5支试管分别用A~E编号后,进行如图所示实验.请回答:
某化学实验小组探究稀盐酸的化学性质,取5支试管分别用A~E编号后,进行如图所示实验.请回答:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 某补钙药剂的标签主要内容如图所示,现测定该钙片含量是否符合标注,做如下实验:取10片该钙片,放入干燥、洁净的烧杯中,再向烧杯中加入50g某浓度稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀盐酸反应,反应中产生的气体全部放出),反应后称量烧杯内剩余物质的质量为64.5g.
某补钙药剂的标签主要内容如图所示,现测定该钙片含量是否符合标注,做如下实验:取10片该钙片,放入干燥、洁净的烧杯中,再向烧杯中加入50g某浓度稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀盐酸反应,反应中产生的气体全部放出),反应后称量烧杯内剩余物质的质量为64.5g.查看答案和解析>>
科目: 来源: 题型:
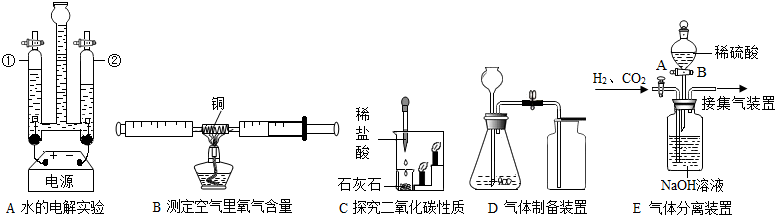
查看答案和解析>>
科目: 来源: 题型:
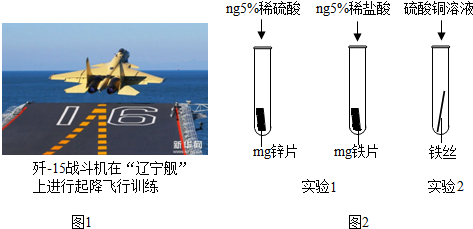
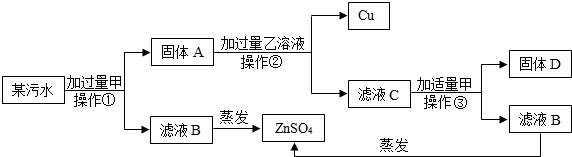
查看答案和解析>>
科目: 来源: 题型:
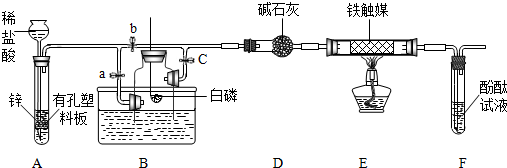
查看答案和解析>>
科目: 来源: 题型:
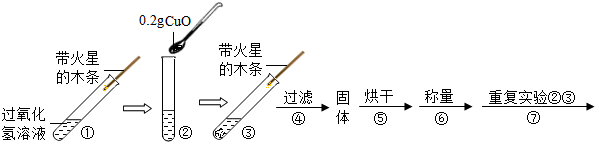
查看答案和解析>>
科目: 来源: 题型:
| 实验 序号 | 过氧化氢的 质量分数/% | 过氧化氢溶液的体积/mL | 温度 /℃ | MnO2的 用量/g | 收集O2的 体积/mL | 反应 时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | 0 | 2 | 49.21 |
| ④ | 30 | 5 | 55 | 0 | 2 | 10.76 |
| 步骤③的现象 | 步骤⑥的结果 | 步骤⑦的现象 | 结论 |
| 带火星木条 | CuO的质量为 | 带火星木条复燃 | 猜想Ⅰ、Ⅱ不成立;猜想Ⅲ成立 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com