
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 某化学学习小组为比较镁和铝的金属活动性强弱设计了如下实验方案.
某化学学习小组为比较镁和铝的金属活动性强弱设计了如下实验方案.| 实验步骤 | 预计实验现象 | 预计结果 |
查看答案和解析>>
科目: 来源: 题型:
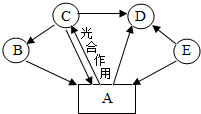 A、B、C、D、E是初中化学常见物质,转化关系如图(图中部分反应物、生成物及反应条件被省略):已知B是一种红色固体,相对分子质量为160,A能使澄清石灰水变浑浊,E是化学实验室常用燃料的主要成分,请回答下列问题:
A、B、C、D、E是初中化学常见物质,转化关系如图(图中部分反应物、生成物及反应条件被省略):已知B是一种红色固体,相对分子质量为160,A能使澄清石灰水变浑浊,E是化学实验室常用燃料的主要成分,请回答下列问题:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
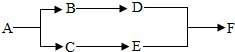 已知A、B、C、D、E、F是初中化学常见的六种物质,其中A、B是组成元素相同的两种液态物质,D是改良酸性土壤常用的碱,F是常用的建筑材料的主要成分,它们之间的转化关系如图所示:
已知A、B、C、D、E、F是初中化学常见的六种物质,其中A、B是组成元素相同的两种液态物质,D是改良酸性土壤常用的碱,F是常用的建筑材料的主要成分,它们之间的转化关系如图所示:查看答案和解析>>
科目: 来源: 题型:
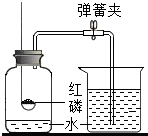 为了测定空气中氧气的含量,按如图所示进行实验:
为了测定空气中氧气的含量,按如图所示进行实验:| 1 |
| 5 |
查看答案和解析>>
科目: 来源: 题型:
 实验室要测定某氯化铜溶液中溶质的质量分数,取该溶液100g,逐滴滴加一定溶质质量分数的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液质量的关系如图所示.(反应的化学方程式:2NaOH+CuCl2=Cu(OH)2↓+2NaCl)
实验室要测定某氯化铜溶液中溶质的质量分数,取该溶液100g,逐滴滴加一定溶质质量分数的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液质量的关系如图所示.(反应的化学方程式:2NaOH+CuCl2=Cu(OH)2↓+2NaCl)查看答案和解析>>
科目: 来源: 题型:
 生活中处处蕴含着化学知识.回答下列问题:
生活中处处蕴含着化学知识.回答下列问题:查看答案和解析>>
科目: 来源: 题型:
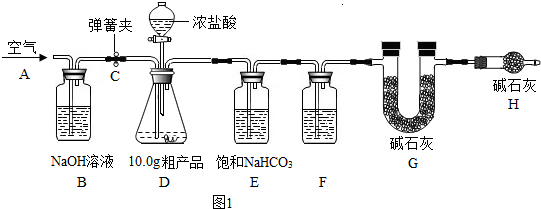
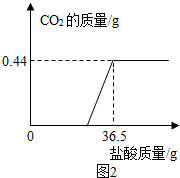
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com