
科目: 来源: 题型:
 草木灰是一种农家肥,它的主要成分是碳酸钾,还有硫酸钾,氯化钾等.化学兴趣小组为测定某草木灰样品中的有效成分,取50g草木灰于烧杯中,不断滴入硫酸溶液,当滴入30g硫酸溶液时,不再有气泡产生,此时烧杯中的残余混合物的质量为77.8g.(假设草木灰的其他成分不含钾元素且不与酸反应)请计算回答:
草木灰是一种农家肥,它的主要成分是碳酸钾,还有硫酸钾,氯化钾等.化学兴趣小组为测定某草木灰样品中的有效成分,取50g草木灰于烧杯中,不断滴入硫酸溶液,当滴入30g硫酸溶液时,不再有气泡产生,此时烧杯中的残余混合物的质量为77.8g.(假设草木灰的其他成分不含钾元素且不与酸反应)请计算回答:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 称量的产品质量/g | 烧杯1 | 烧杯2 | 烧杯3 | 烧杯4 |
| 加入纯碱产品质量/g | 1.4 | 2.8 | 5.6 | 7 |
| 烧杯中剩余物质量/g | 50.85 | 51.7 | 53.4 | 54.8 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
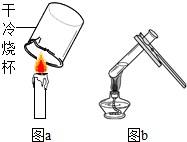 (1)某同学用图a所示的方法检验蜡烛的燃烧产物,将烧杯放在蜡烛火焰上方十几秒钟,发现烧杯壁上没有水雾出现,原因可能是
(1)某同学用图a所示的方法检验蜡烛的燃烧产物,将烧杯放在蜡烛火焰上方十几秒钟,发现烧杯壁上没有水雾出现,原因可能是查看答案和解析>>
科目: 来源: 题型:
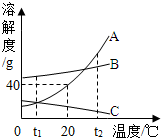 如图为A.B.C.三种物质的溶解度曲线.
如图为A.B.C.三种物质的溶解度曲线.查看答案和解析>>
科目: 来源: 题型:
| 实验操作 | 测定结果 | 白色固体成分 |
| 用pH试纸测定反应后溶液的酸碱度,操作方法是 |
pH>7 | |
| CaCl2 |
查看答案和解析>>
科目: 来源: 题型:
| 稀硫酸用量 | 剩余固体质量 | 稀硫酸用量 | 剩余固体质量 |
| 第一次加入10g | mg | 第四次加入10g | 1.0g |
| 第二次加入10g | 2.0g | 第五次加入10g | 0.6g |
| 第三次加入10g | 1.5g | 第六次加入10g | 0.6g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com