
科目: 来源: 题型:
 某实验小组根据如图所示装置探究燃烧的条件,请回答问题.
某实验小组根据如图所示装置探究燃烧的条件,请回答问题.查看答案和解析>>
科目: 来源: 题型:
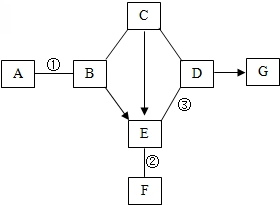 如图是初中化学中常见物质间的转化关系.其中,常温下A、B是黑色固体,B中两种元素的质量比是4:1;C的浓溶液可用作干燥剂;G俗称纯碱;反应②和③各能生成一种沉淀,且沉淀颜色不同.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.
如图是初中化学中常见物质间的转化关系.其中,常温下A、B是黑色固体,B中两种元素的质量比是4:1;C的浓溶液可用作干燥剂;G俗称纯碱;反应②和③各能生成一种沉淀,且沉淀颜色不同.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.查看答案和解析>>
科目: 来源: 题型:
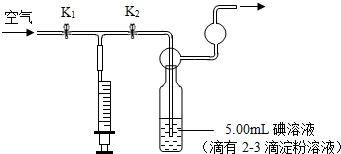
| 实验次数 | 1 | 2 | 3 | 4 | 5 |
| 抽气次数 | 42 | 38 | 36 | 44 | 40 |
| 二氧化硫的含量 | 是否超标 |
查看答案和解析>>
科目: 来源: 题型:
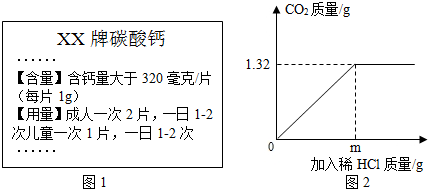
查看答案和解析>>
科目: 来源: 题型:
 实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.
实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度g | 36 | 109 | 215 | 9.6 |
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中,滴加 | 产生大量的气泡 | 该溶液是 |
查看答案和解析>>
科目: 来源: 题型:
| 一定条件 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:

| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com