
科目: 来源: 题型:
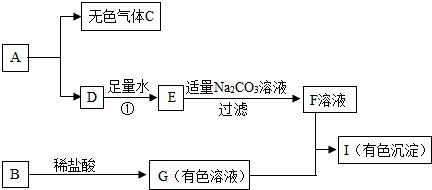
查看答案和解析>>
科目: 来源: 题型:
| 实验步骤 | 解释或结论 |
| (1)将清新洁净的空气通过NaOH溶液,再通过浓硫酸. | ①通过NaOH溶液的目的是除去空气中的二氧化碳;该反应的化学方程式 ②通过浓硫酸的目的是为了除去空气中的 |
| (2)将气体通过能红热的铜 | 除尽空气中氧气的化学方程式是 |
| (3)收集剩余气体,并测定其密度 | 密度为1.2572克/升 |
查看答案和解析>>
科目: 来源: 题型:
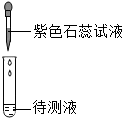 实验课上,甲同学用石蕊试液测定稀盐酸和NaOH溶液的酸碱性,乙同学用石蕊试液测定石灰水和Na2CO3溶液的酸碱性(如图所示).实验后进行废液处理:甲同学将两支试管中的液体倒入烧杯A中,得到蓝色溶液;乙同学将两支试管中的液体倒入烧杯B中,得到蓝色溶液和白色沉淀;最终将A中的溶液和B中的上层清液倒入烧杯C中.
实验课上,甲同学用石蕊试液测定稀盐酸和NaOH溶液的酸碱性,乙同学用石蕊试液测定石灰水和Na2CO3溶液的酸碱性(如图所示).实验后进行废液处理:甲同学将两支试管中的液体倒入烧杯A中,得到蓝色溶液;乙同学将两支试管中的液体倒入烧杯B中,得到蓝色溶液和白色沉淀;最终将A中的溶液和B中的上层清液倒入烧杯C中.| 操作方法 | 实验现象 | 实验结论 |
查看答案和解析>>
科目: 来源: 题型:
 如图是某药厂生产的葡萄糖注射液的标签,其溶质葡萄糖的化学式为C6H12O6.
如图是某药厂生产的葡萄糖注射液的标签,其溶质葡萄糖的化学式为C6H12O6.查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:

| ||


查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 步骤 | 实验操作 | 实验现象 | 结论 |
| 1 | 取少量样品于试管中,加水完全 溶解,再加入 | 乙的猜想 不成立 | |
| 2 | 取步骤1反应后的溶液于试管中 | 无明显现象 | 只有甲的 猜想成立 |
查看答案和解析>>
科目: 来源: 题型:
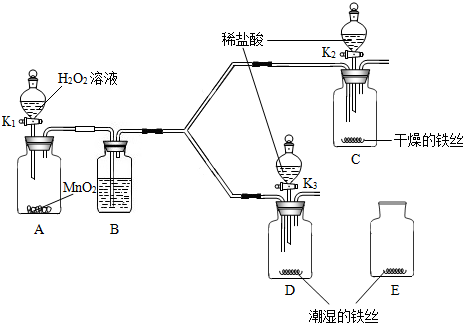
查看答案和解析>>
科目: 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com