
科目: 来源: 题型:
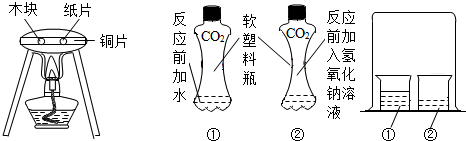
查看答案和解析>>
科目: 来源: 题型:
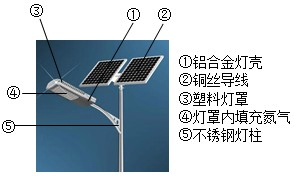 随着科技的不断进步,太阳能路灯(如图所示)越来越多的出现在我们城市道路的两旁.节约能源的同时减少了环境的污染,是实现“低碳生活”的一种典型措施.请你根据图中内容回答下列问题:
随着科技的不断进步,太阳能路灯(如图所示)越来越多的出现在我们城市道路的两旁.节约能源的同时减少了环境的污染,是实现“低碳生活”的一种典型措施.请你根据图中内容回答下列问题:查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
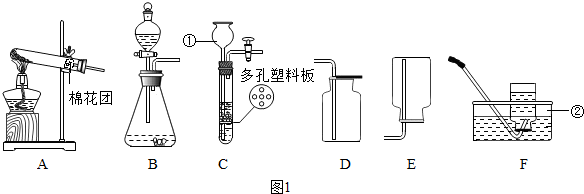
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
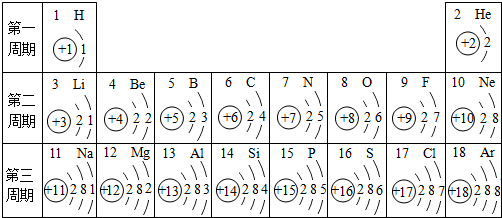
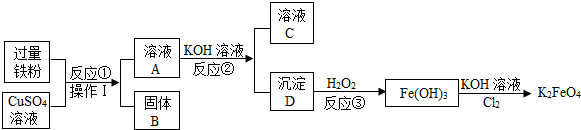
查看答案和解析>>
科目: 来源: 题型:
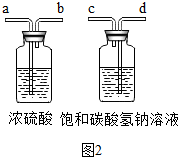
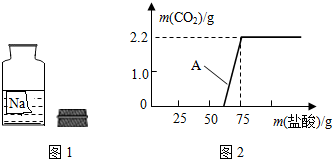 某校兴趣小组同学准备进行常见酸、碱的性质实验时,发现有一装无色溶液的试剂瓶未盖瓶盖且标签破损(如图1),于是决定对这瓶溶液进行实验探究:
某校兴趣小组同学准备进行常见酸、碱的性质实验时,发现有一装无色溶液的试剂瓶未盖瓶盖且标签破损(如图1),于是决定对这瓶溶液进行实验探究:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com