
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
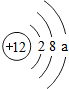 ,则a的值为
,则a的值为查看答案和解析>>
科目: 来源: 题型:
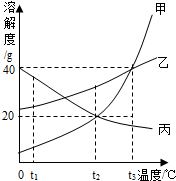 如图是甲.乙.丙三种固体物质的溶解度曲线.根据图示回答:
如图是甲.乙.丙三种固体物质的溶解度曲线.根据图示回答:查看答案和解析>>
科目: 来源: 题型:
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加足量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: |

查看答案和解析>>
科目: 来源: 题型:
| 加入稀盐酸的次序 | 1 | 2 | 3 | 4 |
| 加入稀盐酸的质量/g | 10 | 10 | 10 | 10 |
| 剩余固体的质量/g | 4.0 | m | 0.6 | 0.6 |
查看答案和解析>>
科目: 来源: 题型:
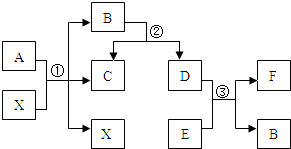 已知A、B、C、D、E、F为常见物质,其中A、B含有相同的元素,B、E为氧化物,C、D、F都为单质.它们相互转化的关系如图所示(图中反应条件略去).
已知A、B、C、D、E、F为常见物质,其中A、B含有相同的元素,B、E为氧化物,C、D、F都为单质.它们相互转化的关系如图所示(图中反应条件略去).查看答案和解析>>
科目: 来源: 题型:
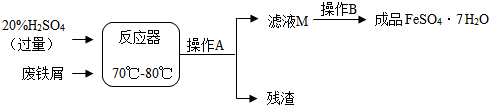
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com