
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
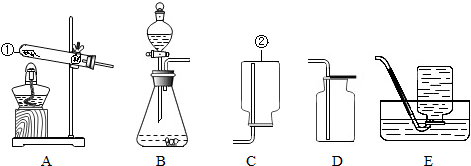
 我国营养学会建议,儿童和青少年每人每天应摄入约1000mg Ca,除从食物中获取外,每天还需通过补钙保健食品摄入400mg钙.某保健品标签如图所示,请你计算:
我国营养学会建议,儿童和青少年每人每天应摄入约1000mg Ca,除从食物中获取外,每天还需通过补钙保健食品摄入400mg钙.某保健品标签如图所示,请你计算:查看答案和解析>>
科目: 来源: 题型:
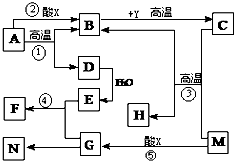 现有几种常见物质,其中D可用作干燥剂、F为红褐色沉淀、M为红棕色固体粉末、N的溶液为棕黄色;反应②为实验室制取某种常见气体的反应.它们之间的相互转化关系如图所示:
现有几种常见物质,其中D可用作干燥剂、F为红褐色沉淀、M为红棕色固体粉末、N的溶液为棕黄色;反应②为实验室制取某种常见气体的反应.它们之间的相互转化关系如图所示:查看答案和解析>>
科目: 来源: 题型:
| ||
| △ |
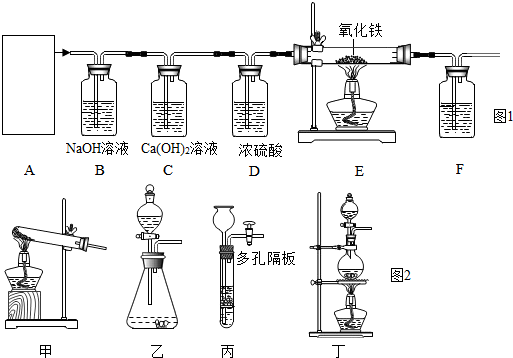
| 400℃~500℃ |
| 500℃~600℃ |
| FeO |
| 黑色 |
| 700℃~800℃ |
| 玻璃管质量 | 玻璃管及其中固体的质量 | 装置F及其中物质的总质量 | |
| 反应前 | 28.20g | 33.00g | 300.0g |
| 反应后 | 32.84g | 300.4g |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
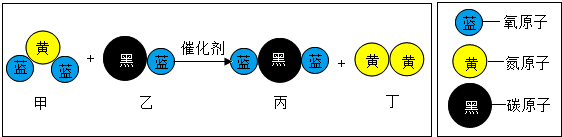
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com