
科目: 来源: 题型:
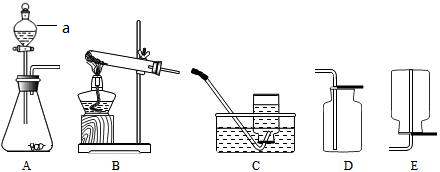
查看答案和解析>>
科目: 来源: 题型:
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl |
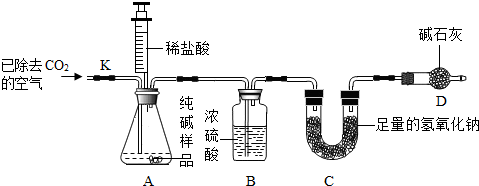
查看答案和解析>>
科目: 来源: 题型:
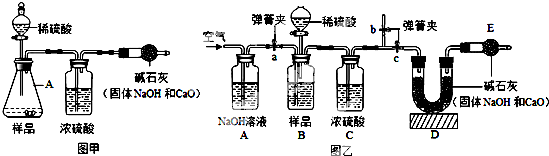
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
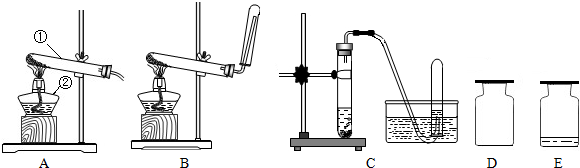
科目: 来源: 题型:

 (2)若实验室里,用一种固体和一种液体混合,制取一瓶干燥的气体单质,应选择的发生、收集装置是
(2)若实验室里,用一种固体和一种液体混合,制取一瓶干燥的气体单质,应选择的发生、收集装置是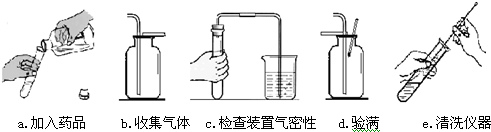
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
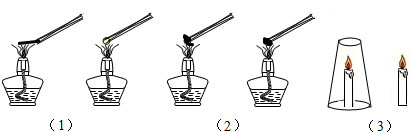
| 实验步骤 | 设计意图 | 实验现象 | 实验结论 |
| (1) | 燃烧与物质的关系 | 可燃物才能燃烧 | |
| (2) | 燃烧与温度的关系 | 没蘸水的小棉团燃烧 蘸水的小棉团不燃烧 | |
| (3) | 玻璃杯内蜡烛熄灭了 玻璃杯外蜡烛仍燃烧 |
查看答案和解析>>
科目: 来源: 题型:
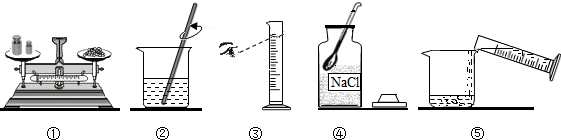
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 稀盐酸的用量 | 剩余固体的质量 |
| 第一次加入10g | 5.5g |
| 第二次加入10g | M |
| 第三次加八10g | 1.2g |
| 第四次加八10g | 1.2g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com