
科目: 来源: 题型:
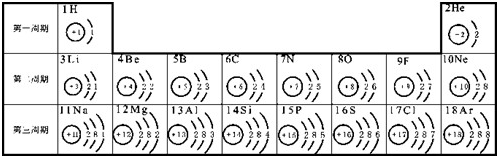
| 物质的类别 | 氧化物 | 酸 | 碱 | 盐 |
| 物质的化学式 |
查看答案和解析>>
科目: 来源: 题型:
 某校研究性学习小组进行了一个有趣的实验探究:
某校研究性学习小组进行了一个有趣的实验探究:查看答案和解析>>
科目: 来源: 题型:
| 1 |
| 10 |
查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
| 实验操作 | 预期实验现象 | 实验结论 |
| 取少量固体剩余物于试管中,向其中加入足量的稀硫酸. | (1)固体部分溶解,溶液为无色. | 假设①成立. |
| (2) |
假设②成立. | |
| (3) |
假设③成立. |
| 实验组别 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | V |
| 药 品 | Al | Fe | Ag | Al | Cu |
| CuO | CuO | CuO | Fe2O3 | Fe2O3 | |
| 相同条件下是否反应 | 是 | 是 | 否 | 是 | 否 |
查看答案和解析>>
科目: 来源: 题型:
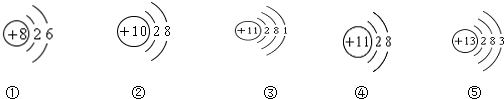
查看答案和解析>>
科目: 来源: 题型:
 如图是甲、乙两种固体物质的溶解度曲线,试回答下列相关问题:
如图是甲、乙两种固体物质的溶解度曲线,试回答下列相关问题:查看答案和解析>>
科目: 来源: 题型:
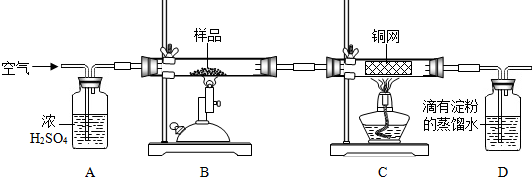
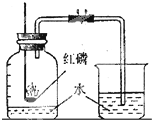 测定空气中氧气含量的实验装置如图所示,实验步骤如下:
测定空气中氧气含量的实验装置如图所示,实验步骤如下:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
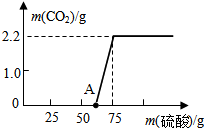
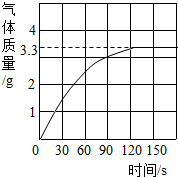 某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢中,产生CO2气体的情况如图所示.提示:反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑ Mg(OH)2+2HCl═MgCl2+2H2O
某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢中,产生CO2气体的情况如图所示.提示:反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑ Mg(OH)2+2HCl═MgCl2+2H2O查看答案和解析>>
科目: 来源: 题型:
 科学家经过多年研究证明,有一些同学爱吃的小包装零食中,含一定量的有毒、有害、致病的化学物质,如某些油炸食品中含有致癌物质丙烯酰胺(C3H5ON),经测定如图产品中含丙烯酰胺(C3H5ON)的质量分数为0.02%.
科学家经过多年研究证明,有一些同学爱吃的小包装零食中,含一定量的有毒、有害、致病的化学物质,如某些油炸食品中含有致癌物质丙烯酰胺(C3H5ON),经测定如图产品中含丙烯酰胺(C3H5ON)的质量分数为0.02%.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com