
科目: 来源: 题型:
 如图是甲、乙两种固体物质的溶解度曲线.回答下列问题:
如图是甲、乙两种固体物质的溶解度曲线.回答下列问题:查看答案和解析>>
科目: 来源: 题型:
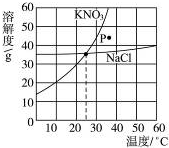 如图为硝酸钾和氯化钠的溶解度曲线.由图可知:
如图为硝酸钾和氯化钠的溶解度曲线.由图可知:查看答案和解析>>
科目: 来源: 题型:
 如图是A、B两种物质的溶解度曲线,回答下列问题:
如图是A、B两种物质的溶解度曲线,回答下列问题:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
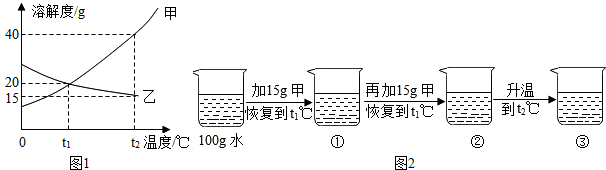
查看答案和解析>>
科目: 来源: 题型:
 如图为a、b两种物质的溶解度曲线.请根据图中内容回答下列问题:
如图为a、b两种物质的溶解度曲线.请根据图中内容回答下列问题:查看答案和解析>>
科目: 来源: 题型:
| 温度(℃) | 10 | 20 | 40 | 60 | 80 |
| KNO3 | 20.9 | 31.6 | 63.9 | 110 | 169 |
| NaCl | 35.8 | 36 | 36.6 | 37.3 | 38.4 |
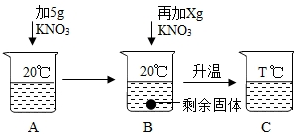
查看答案和解析>>
科目: 来源: 题型:
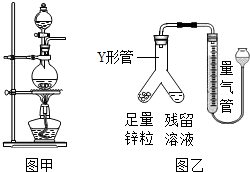 实验室常用MnO2与浓盐酸反应制备Cl2,其反应方程式为:
实验室常用MnO2与浓盐酸反应制备Cl2,其反应方程式为:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com