
科目: 来源: 题型:
化学兴趣小组为测定某石灰石样品中碳酸钙的质量分数,取26g石灰石样品放在烧杯中,然后向其中逐渐加入稀盐酸,使之与样品充分反应,恰好完全反应(杂质不参加反应)时,加入稀盐酸的质量为90g,反应后烧杯中物质的总质量为105g.请计算:
(1)反应生成二氧化碳的质量
(2)样品中碳酸钙的质量分数(结果保留到0.1%)
查看答案和解析>>
科目: 来源: 题型:
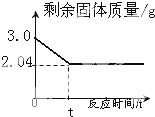
加热氯酸钾和二氧化锰固体混合物制取氧气时,反应时间和剩余固体质量如图.
(1)根据质量守恒定律,该反应产生的氧气质量为 g.
(2)求原固体混合物中氯酸钾的质量是多少?
(3)求剩余固体混合物中二氧化锰的质量分数是多少?
查看答案和解析>>
科目: 来源: 题型:
在一个密闭容器中放入X、Y、Z、Q四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应认识错误的是( )
| 物质 | X | Y | Z | Q |
| 反应前质量(g) | 20 | 2 | 1 | 37 |
| 反应后质量(g) | 未测 | 32 | 1 | 12 |
A.物质Z可能是该反应的催化剂 B.反应后物质X的质量为15g
C.反应中Y、Q的质量比为6:5 D.物质Y一定是单质
查看答案和解析>>
科目: 来源: 题型:
为了测定实验室中氯酸钾样品的纯度,某学习小组取2.5g该样品与0.5g二氧化锰混 合,加热该混合物t1时间后(假设杂质不参加反应),冷却,称量剩余固体的质量,重复以上操作,依次称得加热t1、t2、t3、t4时间后剩余固体的质量,记录
合,加热该混合物t1时间后(假设杂质不参加反应),冷却,称量剩余固体的质量,重复以上操作,依次称得加热t1、t2、t3、t4时间后剩余固体的质量,记录 数据如下表:
数据如下表:
|
| t1 | t2 | t3 | t4 |
| 剩余固体质量/g | 2.48 | 2.34 | 2.04 | 2.04 |
(1)在________时间后,该样品中的氯酸钾已经完全反应 (1分)
(2)完全反应后产生氧气的质量_______________ (1分)
(3)该样品中氯酸钾的质量分数 (4分)
查看答案和解析>>
科目: 来源: 题型:
化学兴趣小组为测定某黄铜(铜锌合金)样品中铜的含量,取10g样品放在烧杯中,然后向其中逐渐加入稀硫酸,使之与样品充分反应,恰好完全反应(杂质不参加反应)时,加入稀硫酸的质量为14g,反应后烧杯中物质的总质量为23.9g.请计算:
(1)反应生成氢气的质量;
(2)样品中铜的质量分数.
查看答案和解析>>
科目: 来源: 题型:
某同学需测定某100g过氧化氢溶液中所含过氧化氢的质量.他取10g二氧化锰放入烧杯中,并将该过氧化氢溶液全部加入,不同时间用电子天平测量其质量,所得读数如表所示:
| 反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 烧杯及所盛物质总质量/g | 335.70 | 334.30 | 334.00 | 333.50 | 333.00 | 332.50 | 332.50 |
(1)试分析,100g过氧化氢溶液完全反应后生成氧气的质量为 .
(2)计算100g过氧化氢溶液中过氧化氢质量分数为多少?(写出计算过程)
(3)请分析该方法测定结果可能会偏大的原因有 (写出一点即可).
查看答案和解析>>
科目: 来源: 题型:
有一种自生氧防毒面具,其使用的生氧剂的主要成分是(KO2).取100g生氧剂放入质量为20g烧杯中,再向其中加入20g水,使生氧剂KO2全部反应,其充分反应后(4KO2+2H2O═4KOH+3O2↑),称得烧杯及烧杯中物质的总质量为116g,计算(假设杂质不含钾元素且不与水反应)
(1)100g生氧剂生成氧气的质量;
(2)生氧剂中含钾元素的质量分数.
查看答案和解析>>
科目: 来源: 题型:
把干燥、纯净的氯酸钾和二氧化锰的混合物15.5克装入大试管中,加热制取氧气.待反应完全后,将试管冷却、称量,得到10.7克固体物质,计算:
(1)制得氧气多少克?
(2)原混合物中,氯酸钾和二氧化锰的质量各多少克?
查看答案和解析>>
科目: 来源: 题型:
某化学小组为测定一瓶失去标签的盐酸的溶质质量分数,分成甲、乙两组,分别用不同的方法进行测定.
实验设计:
甲组:取纯净碳酸钙粉末5g于烧杯中,加入20g该盐酸溶液,充分反应后,过滤、洗涤、干燥,称量得剩余固体3g.
乙组:取纯净碳酸钙粉末5g于锥形瓶中,将20g该盐酸溶液加入分液漏斗,利用测定产生二氧化碳的体积(20℃、标准大气压)计算盐酸浓度.装置示意图如图:
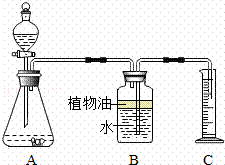
数据处理:
(1)请利用甲组数据计算该盐酸的溶质质量分数.(写出计算过程)
(2)乙组计算结果略小于甲组.经过多次实验仍得到相同结果(忽略量筒引起的误差),可能的原因是 .
查看答案和解析>>
科目: 来源: 题型:
实验室探究氧气的性质需要一定质量的氧气.我校一化学兴趣小组为了探究氧气的性质需,用托盘天平准确称取3.16g高锰酸钾装入试管连接装置,加热制取和收集氧气,待高锰酸钾完全反应后,称剩余固体物质的质量为2.84g.请你参与计算:
(1)在锰酸钾中钾元素和锰元素的质量比为 ;
(2)3.16g高锰酸钾完全反应后,收集的氧气的质量为 (理论值,不计损失);
(3)在剩余固体物质中,由于锰酸钾能溶于水,二氧化锰不溶于水,可用溶解、过滤、烘干的方法获得纯净的二氧化锰,作为氯酸钾或过氧化氢溶液分解的催化剂.在上述反应中,最多可回收多少二氧化锰?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com