
科目: 来源: 题型:
在研究酸和碱的化学性质时,某小组想证明稀硫酸和氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应。试与他们一起完成实验方案的设计、实施和评价,并得出有关结论。
(1)探究稀硫酸和氢氧化钠溶液的反应:
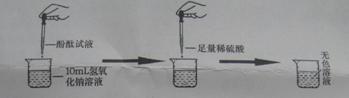 当滴入几滴酚酞试液后,溶液由无色变为 色。根据上述实验中颜色变化,可确定稀硫酸和氢氧化钠溶液发生了化学反应,反应的化学方程式为: ;
当滴入几滴酚酞试液后,溶液由无色变为 色。根据上述实验中颜色变化,可确定稀硫酸和氢氧化钠溶液发生了化学反应,反应的化学方程式为: ;
(2)探究上述稀硫酸和氢氧化钠溶液反应后烧杯中的硫酸是否过量:
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量。同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并分析:
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 稀硫酸过量 |
| 方案二 | 取样,滴入几滴紫色石蕊试液 | 溶液变红 | 稀硫酸过量 |
上述设计的实验方案中,正确的是 (填“方案一”或“方案二”);
另外一个实验方案错误的原因是 ;
若请你再设计一个确定稀硫酸是否过量的实验方案,你选用的药品是 ,实验现象及结论是 。
查看答案和解析>>
科目: 来源: 题型:
学校化学实验室新购买的药品有:白磷、铝片、乙醇、硝酸、氢氧化钠等。
(1)从物质分类的角度看:属于金属单质的是 ;属于有机物的是 ;
(2)从物质存放方法的角度看:
① 白磷应保存在盛有 的广口瓶中;
②硝酸保存在棕色细口瓶中,原因是见光易分解。硝酸见光分解的化学方程式: 4HNO3 4X↑+O2↑+2H2O ,其中X的化学式为 ;
4X↑+O2↑+2H2O ,其中X的化学式为 ;
③氢氧化钠要密封保存,因为敞口放置容易变质。用化学方程式表示变质的原因 。
查看答案和解析>>
科目: 来源: 题型:
为探究气体X的组成,某兴趣小组进行图所示实验(固定装置未画出)。
【资料在线】
(1)加热条件下,气体X能与氧化铜反应生成铜、水和氮气。
(2)碱 石灰为固体氢氧化钠和氧
石灰为固体氢氧化钠和氧 化钙的混合物,不与气体X反应。无水氯化钙可吸收气体X。
化钙的混合物,不与气体X反应。无水氯化钙可吸收气体X。
(3)本实验条件下,氮气密度为1.15g·L-1,装置内空气中的水与二氧化碳对相关数据测定的影响可忽略不计。
【实验步骤】
(1)连接仪器,并检查装置气密性。
(2)取一定量氧化铜,准确称得其质量为2.40g。
(3)按图所示装入药品,测量并记录相关数据Ⅰ(见表)。
(4)连接A、B、C装置, 将气体X缓缓通入一段时间后,连接上D装置,读数后开始加热。当A装置中氧化铜反应完全,停止加热,继续通入气体X至玻璃管冷却,再次测量并记录相关数据Ⅱ(见表)。
【实验装置】

【相关数据】
| 测量项目 数据编号 | I | II |
| 玻璃管(含药品)的质量/g | 52.40 | 51.92 |
| B装置(含药品)的质量/g | 102.00 | 102.54 |
| 氮气的体积/mL | 243.5 |
【回答问题】
⑴B装置中氧化钙吸水的原理为 (用化学方程式表示)。
⑵实验过程中,当观察到 ,说明氧化铜已反应完全,停止加热,继续通入气体X至玻璃管冷却的目的是 。
⑶分析 实验测量的数据,生成水的质量为 g,氧化铜中氧元素的质量为 g。由此推知,气体X中一定 (填“有”或 “没有”)氧元素。
实验测量的数据,生成水的质量为 g,氧化铜中氧元素的质量为 g。由此推知,气体X中一定 (填“有”或 “没有”)氧元素。
⑷通过计算推导出气体X的化学式。
查看答案和解析>>
科目: 来源: 题型:
为了鉴别碳酸钾溶液和氢氧化钾溶液,同学们进行了探究实验:分别取两种溶液于两支试管中,各滴入一定量的氯化钙溶液。观察到一支试管中出现白色浑浊。实验结束后,同学们将废液倒入同一个干净的烧杯中,发现废液变浑浊。同学们对废液进行了过滤,并对滤液的成分进行了探究。
【提出问题】滤液中除水外还含有哪些物质?
【猜想】A.可能含有氢氧化钾、氯化钾和碳酸钾
B.可能含有氢氧化钾、氯化钾
C.可能含有氢氧化钾、氯化钾、碳酸钾和氯化钙
你认为还可能是 (写一种猜想)。
【讨论】你认为 猜想不合理(填字母),请说明理由 。
【实验设计】设计一个简单的实验。证明你的猜想正确。
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中, |
| 猜想正确 |
【反思交流】写出碳酸钾与氯化钙反应的化学方程式 。在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑 。
查看答案和解析>>
科目: 来源: 题型:
定性和定量结合既是化学的重要思 想,也是研究物质组成的重要方法。某研究性学习小组为检测实验室用氢气还原氧化铜所得红色固体Cu中是否含有Cu2O(红色),进行了认真的探究。请你一起踏上探究之路,回答下列问题。
想,也是研究物质组成的重要方法。某研究性学习小组为检测实验室用氢气还原氧化铜所得红色固体Cu中是否含有Cu2O(红色),进行了认真的探究。请你一起踏上探究之路,回答下列问题。
【查阅资料】①无水CuSO4遇水变蓝 ②高温灼烧CuO生成Cu2O和O2
③Cu2O与稀硫酸反应:Cu2O+H2SO4=Cu+CuSO4+H2O
【设计实验方案】
方案1 取该红色固体加入适量稀硫酸,实验现象 ,结论为红色固体中含有Cu2O。
方案2 装置如下图所示,拟通过干燥管中CuSO4变蓝来判断红色固体是否含有Cu2O。

(1)为确保探究的科学、合理、安全。实验中还应采取的措施有 (填序号);
①加热前先排尽装置中的空气
②在氢气发生器与硬质玻璃管之间加一个干燥装置
③在盛有CuSO4的干燥管后再连接一个装有浓硫酸的洗气瓶
(2)由方案2实验后得出结论:红色固体中含有Cu2O。写出红色固体Cu2O与H2反应的化学方程式 。
方案3 称得干燥坩埚(常用于固体加热的容器)的质量为ag,取红色固体置于坩埚中称得总质量为bg,在空气中高温灼烧至质量恒定,称得最后坩埚与固体总质量为cg。
(1)该实验方案最少得进行 次称量。
(2)若确认红色固体中含有Cu2O,则c与a、b应符合的数学表达式为 。
查看答案和解析>>
科目: 来源: 题型:
某化学兴趣小组的同学对呼吸面具的制氧原理产生了好奇心,通过查阅资料得知,呼吸面具中制取氧气的主要原料是固体过氧化钠(Na2O2),过氧化钠分别能和二氧化碳、水反应,都能生成氧气,反应的化学方程式为:
2 Na2O2+2H2O=4NaOH+ O2↑ 2 Na2O2+2CO2=2Na2CO3+ O2
为测定呼吸面具中过氧化钠的质量分数,该小组的同学在教师的指导下,利用下图所示的装置(固定装置已略去)开展探究,并得出正确结论。
 已知装置B中盛有饱和NaHCO3溶液(NaHCO3不与CO2反应),碱石灰是由固体NaOH和CaO组成的混合物。整套装置气密性良好,反应所需试剂均足量。
已知装置B中盛有饱和NaHCO3溶液(NaHCO3不与CO2反应),碱石灰是由固体NaOH和CaO组成的混合物。整套装置气密性良好,反应所需试剂均足量。
请回答下列问题:
⑴仪器a的名称是 ,装置A的作用是 ;
⑵不用装置E取代装置C的理由是 ;
⑶装置D中过氧化钠样品的质量为m g,装置D在反应前后质量分别为n1 g和n2 g,若样品中所含杂质既不溶于水,也不参加化学反应,则样品中过氧化钠的质量分数= 。(Na-23 O-16 C-12 H-1)
查看答案和解析>>
科目: 来源: 题型:
某同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,同学们提出了如下假设:
【猜 想】猜想一:没有变质; 猜想二:部分变质; 猜想三: ① 。
【查阅资料】Na2CO3溶液呈碱性。
【进行实验】对猜想二进行验证。
| 实验步骤 | 实验现象 | 结论 |
| 1. 取少许该溶液于试管中,滴 入适量的 ② 溶液。 | ③ | 猜想二正确 |
| 2.静置上述溶液,取上层清液少许于另一支试管中,滴入几滴 ④ 溶液 | ⑤ |
写出现象③的化学方程式 ⑥ 。
【反 思】氢氧化钠溶液必须密封保存。
氢氧化钠溶液变质的原因(用化学方程表示) ⑦ 。
查看答案和解析>>
科目: 来源: 题型:
取少量碳酸氢钠(NaHCO3)粉末,用如图装置进行实验,充分加热后发现,大试管中管口有水珠出现,管底有白色固体残留;小试管中澄清石灰水变浑浊,完全反应后,取残留固体溶于水配成溶液,往该溶液中滴加CaCl2溶液,有白色沉淀生成。

(1)小试管中澄清石灰水变浑浊,说明碳酸氢钠受热有 生成(填化学式)。
(2)通过上述实验,下列归纳出的碳酸氢钠性质或推理正确的有 (填编号)
A.NaHCO3能与NaOH溶液发生反应
B.NaHCO3受热易分解:2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.加热时NaHCO3比Na2CO3易分解
D.无法比较NaHCO3与Na2CO3受热分解的难易程度
查看答案和解析>>
科目: 来源: 题型:
在盐酸除铁锈的实验中,我们常会发现生锈的铁钉表面有一些气泡产生。气泡是怎么产生的? 针对这一问题,同学们提出了有关假设,并设计了如图甲所示的实验方案进行探究。实验时,观察到放有铁的试管中有气泡产生,而另一试管中没有,从而验证了自己的假设是成立的。
针对这一问题,同学们提出了有关假设,并设计了如图甲所示的实验方案进行探究。实验时,观察到放有铁的试管中有气泡产生,而另一试管中没有,从而验证了自己的假设是成立的。

(1)分析上述实验,你认为同学们建立的假设是____________。
(2)有同学认为上述实验不够严谨,溶液中的水可能会对实验产生影响。于是他们又进行了对照实验。请你在答题卷的虚线框中用图示的形式将图乙的对照实验补充完整。
(3)还有同学想:气体会不会是铁锈与水反应产生的?他认为还要补充一个铁锈与水反应的实验,你觉得有没有必要?________________。
查看答案和解析>>
科目: 来源: 题型:
(1)用图I装置测定空气中氧气的含量,证明空气中氧气的体积分数约为1/5, a, b两
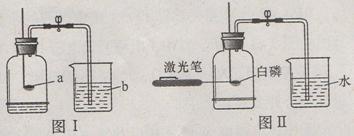 种物质可选用(填序号)。
种物质可选用(填序号)。
A.红磷、水
B.木炭、水
C.硫、NaOH溶液
D.小蜡烛、NaCl溶液
思敏同学对该实验进行反思后,提出了改进方法(如图II所示),你认为改进后的优点是(任写两点) 。
(2)“炭火烧烤”是许多同学喜爱的食物,其原理是利用木炭燃烧的高温来烤熟食物,炭燃烧反应的化学方程式是。冬天,在门窗紧闭的房间里吃“烧烤”,容易发生的危险是。如果在红热的木炭上撤一些氧化铁红棕色粉末,可能发生反应的化学方程式是 。
(3)冬季,园林工人在树干上涂石灰浆以保护树木免受虫害。某化学兴趣小组的同学
欲对工人用剩的石灰浆进行探究。
【提出猜想】石灰浆中除水之外的物质是什么?
I.只有Ca(OH)2; II.只有 ;III. 。
【实验验证】①要证明石灰浆中含有Ca(OH)2,可采取的操作及现象是。
②取石灰浆少量,盛装在试管中,如果向其中加入,观察到,则证明猜想II或III正确。
【思维拓展】工业上用石灰浆与Cl2反应制漂白粉,用来杀菌消毒。
① 配平下列化学方程式:Cl,+Ca(OH)=CaCl2+Ca(ClO)2+H,0
② 百度得知,漂白粉杀菌消毒的原理是:其中的Ca(CIO)2能与某些酸反应,生成的HCIO具有强氧化性,且不与CaCO3反应。写出CO2通人漂白粉溶液中发生反应的化学方程
式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com