
科目: 来源: 题型:
碱式碳酸盐广泛应用于工农业生产。
(1)某碱式碳酸盐药品M(OH)2·MCO3,为确定金属M的相对原子质量,某研究小组设计如下实验装置及步骤(不考虑植物油中溶解CO2产生的影响)。

①连接装置并_________;②准确称量样品的质量;③装药品,调节量气装置两边液面相平,读数;④加热至样品质量不再减少;⑤冷却到室温;⑥调节量气装置两边液面相平,读数、列式计算。
I.请将上述实验步骤补充完整。
II.装置B的作用是_________,少量植物油的作用是_________,C中的试剂是_________ (填字母序号)。
a.碱石灰 b.浓硫酸 c.硫酸铜
III.步骤⑥中调节液面相平的操作是将水准管_________(填“缓慢上移”或“缓慢下移”)。
IV.若其它操作均正确,仅因下列因素可使M相对原子质量的测定结果偏大的是_________ (填字母序号)。
a.反应前量气管水面在0刻度处,反应后仰视读数
b.样品未分解完全即停止实验
c.量气管中未加植物油
(2)实际生产中的碱式碳酸铜可表示为Cu(OH)2·mCuCO3,某研究小组仍使用上述装置测定m的值,测得3组数据如下表所示。取3组数据的平均值得到CO2的体积为______mL,又已知常温常压下CO2的密度为1. 964 g/L,据此计算m的值。(写出计算m的过程,最后结果保留小数点后两位)

查看答案和解析>>
科目: 来源: 题型:
在一堂化学实验课上,老师为每组同学分别提供了一瓶氢氧化钠溶液,让他们用1%的稀盐酸来测定其溶质的质量分数。以下是几组同学的设想及做法:
|
 |
请回答:
①酚酞溶液的作用是 ▲ ;
②边滴加稀盐酸,边要用玻璃棒不断搅拌的目的是 ▲ 。
③当溶液颜色恰好变为无色时,共用去了稀盐酸7.3g,则甲组这瓶氢氧化钠溶液中溶质的质量分数为 ▲ (写出计算过程,结果用百分数表示)。
(2)乙组同学的设想是:在烧杯中加入一定量的氢氧化钠溶液,用滴管慢慢滴入1%的稀盐
酸,并不断搅拌,通过用pH试纸多次测定溶液pH的办法,达到实验目的。
①下列使用pH试纸的方法正确的是 ▲ (填字母)。
A.将pH试纸剪成几段节约使用
B.将pH试纸直接插入待测液中
C.将pH试纸放在干净的白瓷板上,用玻璃棒蘸取待测液滴在pH试纸上
D.将pH试纸润湿后放在玻璃片上,用玻璃棒蘸取待测液滴在pH试纸上
 ②由于用pH试纸需多次测定,较繁琐,且所测数值不够精确。在老师指导下,乙组同学取了5g氢氧化钠溶液进行了数字化实验,由计算机描绘出了整个实验过程中溶液pH的变化图像(简单表示为下图)。
②由于用pH试纸需多次测定,较繁琐,且所测数值不够精确。在老师指导下,乙组同学取了5g氢氧化钠溶液进行了数字化实验,由计算机描绘出了整个实验过程中溶液pH的变化图像(简单表示为下图)。
请回答:图中a点表示的含义是 ▲ ;b点溶液中含有的阳离子有 ▲ (填离子符号);乙组同学要计算出本组这瓶氢氧化钠溶液中溶质的质量分数,除了要用到已有数据外,你认为还需要的数据是 ▲ 。
(3)丙组同学在滴加稀盐酸一段时间后,发现溶液中有少量气泡产生。这一“异常现象”激起了他们的探究欲望, 通过实验证明:该组用的这瓶氢氧化钠溶液已经部分变质。
通过实验证明:该组用的这瓶氢氧化钠溶液已经部分变质。
请用化学方程式表示其变质的原因 ▲ ;若要除去溶液中变质生成的杂质,请简要写出你的实验方案: ▲ 。
查看答案和解析>>
科目: 来源: 题型:
氢氧化钠是一种重要的化工原料。
(1)氢氧化钠俗称是 。
(2)利用题18图所示装置(固定装置略)进行NaOH溶液与CO2气体反应的实验。
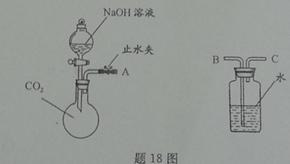
若A与C连接,将分液漏斗中部分NaOH溶液注入烧瓶中,然后关闭活塞并打开止水夹,观察到的实验现象是 ;CO2与NaOH溶液反应的化学方程式为 。
(3)已知:Na2CO3+H2O+CO2=2NaHCO3;NaHCO3+NaOH=Na2CO3+H2O.将(2)中实验后烧瓶内的溶液在低温下蒸干得到白色固体X,则X的组成可能有四种情况,分别是:
I.NaOH、Na2CO3;II. ;III. ;IV.NaHCO3。
(4)根据以上信息,请设计一种以100mL未知浓度的NaOH溶液和CO2气体为原料获得Na2CO3溶液的简便方法 。
查看答案和解析>>
科目: 来源: 题型:
地球上的金属资源广泛地存在于地壳和海洋中,工业上主要是从含有金属元素并有开采价值的矿石中提炼金属。
(1)赤铁矿在自然界中储藏丰富,其主要成分的化学式是 。
(2)磁铁矿的主要成分是Fe3O4。在Fe3O4中存在两种不同价态的铁离子,其中1/3是Fe2+,2/3是Fe3+。请写出Fe3O4与盐酸反应的化学方程式 。
(3)工业上主要采用高炉炼铁,常用到的原料有铁矿石、焦炭、石灰石和空气。其中,焦炭的作用是 。(仅答一点)
(4)由于铁的氧化物中Fe3O4和FeO均为黑色,实验室用CO还原Fe2O3得到的铁中是否会含有Fe3O4和FeO,某同学设计了下列探究实验。
资料:FeCl3溶液与铁发生的反应是2FeCl3+Fe=3FeCl2,但FeCl3溶液不与Fe3O4和FeO反应;含有Fe3+的盐溶液遇到KSCN溶液时变成红色,利用该反应可检验的Fe3+存在。
【提出问题】CO还原Fe2O3得到黑色产物的成分是什么?
【猜想】
猜想1:Fe; 猜想2:Fe和Fe3O4; 猜想3:Fe和FeO; 猜想4: 。
【实验探究】限选试剂:CO、盐酸、澄清石灰水、KSCN溶液、FeCl3溶液。
| 实验操作 | 实验现象 | 实验结论 |
| I取少量黑色产物加入到装有足量FeCl3溶液的烧杯中,充分反应后过滤,对过滤所得固体用蒸馏水洗涤。 | 黑色固体部分溶解。 | 猜想2和4都不成立 |
| Ⅱ ① 。 | 黑色固体全部溶解,溶液不变红色。 | |
| Ⅲ另取少量黑色产物装入玻璃管中,通入CO,一段时间后加热,并将反应后的气体通入装有一定量的 ② 的烧杯中。 | ③ 。 | 猜想1不成立,猜想3成立。 |
查看答案和解析>>
科目: 来源: 题型:
学习了CO2的有关知识后,同学们查阅资料发现Mg能在CO2中燃烧:CO2+2Mg C+2MgO。所以镁着火不能用CO2来灭火,但没有找到有关Na与CO2反应的介绍。于是同学们展开了钠着火能否用CO2来灭火的探究。
C+2MgO。所以镁着火不能用CO2来灭火,但没有找到有关Na与CO2反应的介绍。于是同学们展开了钠着火能否用CO2来灭火的探究。
【提出问题】钠能发生类似于CO2与镁的反应,可能的化学方程式为 。
【实验】将燃着的钠伸入装有CO2的集气瓶中,钠能在集气瓶中继续燃烧。
进一步【查阅资料】得知:
①Na2O是白色固体,能与CO2反应生成Na2CO3,也能与H2O反应生成NaOH.
②Ba (OH )2溶于水而BaCO3不溶于水。
③Na2CO3的存在会干扰NaOH的检测。
基于以上资料,同学们认为钠在CO2中燃烧的产物情况有所不同,并对产物提出了以下几种猜想:
I.Na2O、C;II. 、III.NaOH、C;IV.Na2O、Na2CO3、C
通过理论分析,猜想 (填序号)肯定是错误的,理由是 。
(验证猜想)
| 步骤 | 实验操作 | 主要实验现象 | 结论(燃烧产物判断) |
| (1) | 将产物溶于适量水中 | 部分溶解,试管底部有黑色固体 | 燃烧产物中肯定有C |
| (2) | 取少量(1)所得上层溶液,加入过量的BaCl2溶液 |
| 燃烧产物中肯定有Na2CO3 |
| (3) | 取少量(2)所得上层清液,加入 溶液 | 有蓝色沉淀生成 | 燃烧产物中肯定有 |
在步骤(2)中BaCl2溶液为什么要加入至过量?其原因是: 。
【结论】猜想 (填序号)是正确的。
查看答案和解析>>
科目: 来源: 题型:
糕点疏松剂的主要成分中还有碳酸氢钠,某化学兴趣小组对碳酸氢钠的化学幸会进行探究。
【探究实验一】 碳酸氢钠溶液的酸碱性:用PH试纸测得碳酸氢钠溶液的pH约为10。 由此得出的结论是碳酸氢钠溶液呈 。
【探究实验二】 碳酸氢钠能否与酸反应:取少量固体放入试管中,滴加足量的稀盐酸, 现象为 。结论:碳酸氢钠能与酸反应。
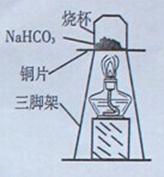 【探究实验三】 碳酸氢钠的热稳定性:取一定量的碳酸氢钠放在 铜片上加热,如图所示。
【探究实验三】 碳酸氢钠的热稳定性:取一定量的碳酸氢钠放在 铜片上加热,如图所示。
(1) 加入一段时间后,观察到烧杯内壁有水珠。
(2) 充分加热后,将烧杯迅速倒转过来,加入适量的澄清石灰水,震荡,观察到澄清石灰水变浑浊。
(3) 通过进一步实验来确定充分加热后的固体产物的成分。限选试剂及仪器:稀盐酸、氯化钙溶液、澄清石灰水、酚酞溶液、蒸馏水、试管、胶头滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量加热后的固体产物放入试管A中,加入适量蒸馏水,充分振荡溶解,滴加足量_________,振荡,静置。 | 产生白色沉淀 | 产物含Na2CO3 |
| ② | 取操作①后的上层清液于试管B中,滴加_________。 | _________ | 产物不含NaOH |
(4)根据上述实验结论,写出碳酸氢钠受热分解的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
某兴趣小组在做完碳还原氧化铜实验后,进行了题23图所示的探究:
 题23图
题23图
【猜想】把氧化铜还原成铜的物质是:I.石墨棒;II· 。
【实验】用天平称量1.5g氧化铜粉末,直接用铝箔纸包裹。按上述操作步骤实验,黑色粉末. ,那么猜想Ⅱ不成立。
【结论】石墨棒能使氧化铜还原成铜,该反应的化学方程式为 。
【改进】把石墨棒换成铝粉,重复上述操作,又获成功。那么,称取等量的铝粉并进行同样
的操作,其目的是 。改进后的实验证明,金属铝与铜活动性顺序是
. ,该反应的化学方程式为 。
【拓展】如果使用复印机的“碳粉”代替石墨棒还原氧化铜,效果更好。联想在空气中灼热
的铁丝不能燃烧,而铁粉能燃烧,其原因是 。
查看答案和解析>>
科目: 来源: 题型:
某化学兴趣小组要用80g10%的氢氧化钠溶液制作叶脉书签,下图是他配制溶液的操作示意图。

(1)称量氢氧化钠固体时,不能将氢氧化钠直接放在纸上称量的原因是____________________。
(2)配制上述溶液,下列操作失误,会引起溶质质量分数降低的是______
a用量筒取水时,仰视读数
B.将量筒中的水倒入烧杯时,有少量的水溅出
(3)一周后,该实验小组的同学整理实验时时,发现氢氧化钠固体忘记了盖瓶盖,老师告知,此瓶氢氧化钠已变质,但不知变质的程度。为此,该化学兴趣小组在老师的指导下,进行了实验。
【查阅资料】氯化钙和氯化钡溶液都呈中性。
【提出问题】①氢氧化钠变质的原因?用化学反应方程式表示_________________________-
②氢氧化钠的变质程度如何?
【实验设计】化学兴趣小组分成甲乙两组进行探究实验。
甲组的方案:取少量固体样品于烧杯中,加足量的水溶解,加入氢氧化钙溶液,知道不再产生沉淀为止,静置,滴入酚酞试液,溶液变红,证明氢氧化钠部分变质。
乙组不同意甲的方案,理由是_______________________________。
乙组方案,根据所提供的药品设计实验方案,请你完成下表。
提供的药品:酚酞试液、稀盐酸、氯化钡溶液、氯化该溶液、氢氧化钙溶液、蒸馏水
| 实验步骤 | 实验现象 | 结论 |
| a.取少量氢氧化钠固体于试管中 b.加入足量的蒸馏水完全溶解 C.__________________ d._______________ |
___________________; _____________________ | 氢氧化钠固体部分变质 |
查看答案和解析>>
科目: 来源: 题型:
根据下图回答问题

(1)写出图中标号①的仪器名称___________;
(2)实验室用锌粒和稀硫酸制取并收集较为纯净的氢气,所用装置是_______________(填序号,下同),反应的化学方应方程式是_____________________________。
(3)已知铜和浓硝酸反应能制取二氧化氮气体,二氧化氮是一种红棕色的气体,密度大于空气。
①制取二氧化氮气体选用的发生装置是____________,向试管中装入铜片的正确操作是______________________。
②用图中F装置演示分子运动的实验时,为缩短演示时间,二氧化氮最好放在_______(填上或下)瓶的集气瓶中,抽取两瓶间的玻璃片,可以看到的现象是___________________。
查看答案和解析>>
科目: 来源: 题型:
呼吸面具中的“氧气再生剂”,主要成分是淡黄色固体过氧化钠(Na2O2),使用后变成白色固体。某兴趣小组对白色固体的成分进行了探究。
【作出猜想】根据呼出的气体中含有较多的,作出如下猜想:
猜想一:氢氧化钠 猜想二:碳酸钠 猜想三:氢氧化钠和碳酸钠
【实验验证】(1)小明取少量白色固体,加水溶解,然后滴加酚酞溶液,溶液变红色。认为白色固体中一定含有氢氧化钠。
同学们认为小明的实验不能得出这一结论,理由是 。
(2)小红取少量白色固体,加入稀盐酸,有气泡产生,证明白色固体中一定含有碳酸钠。该反应的化学方程式为 。
(3)小玉取少量白色固体,加水溶解,再加入足量的氯化钙溶液,充分反应后过滤,向滤液中滴加硫酸铜溶液,观察到 ,说明白色固体中含有氢氧化钠。
【得出结论】猜想三成立。
【拓展应用】“氧气再生剂”的保存方法是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com