
科目: 来源: 题型:
为测定某CuSO4溶液的溶质质量分数,化学小组的同学取CuSO4溶液100g,向其中滴加一定浓度的NaOH溶液,至不再产生沉淀为止,共用去NaOH溶液80g,过滤,得到滤液175.1g.请计算:
(1)该反应生成沉淀 _____g;
(2)该CuSO4溶液中溶质的质量分数.
(温馨提示:CuSO4+2NaOH═Cu(OH)2↓+Na2SO4)
查看答案和解析>>
科目: 来源: 题型:
为了节约林木资源,近几年兴起的石头纸,石头纸可用沿海水产养殖中产生的大量废弃贝壳制得。为了测定某种贝壳中碳酸钙的质量分数,取贝壳25g,加入200g的稀盐酸,恰好完全反应,称得反应后物质的总质量为 216.2g(假设贝壳中其他物质不与盐酸反应且不溶于水)。请你计算:
216.2g(假设贝壳中其他物质不与盐酸反应且不溶于水)。请你计算:
(1)贝壳中碳酸钙的质量分数;
(2)反应后所得溶液中溶质的质量分数(精确到0.1%)。
查看答案和解析>>
科目: 来源: 题型:
工业上常用NaOH溶液处理铝土矿(主要成分Al2O3),反应的化学方程式:Al2O3+2NaOH=2NaAlO2+H2O。欲对含Al2O3 204 t 的铝土矿进行处理(杂质不参与反应),理论上需要消耗NaOH的质量为多少?
查看答案和解析>>
科目: 来源: 题型:
工业上采用离子交换膜电解槽电解饱和食盐水,可以得到高浓度的烧碱溶液(含NaOH35%~48%)。某学习小组为了验证附近氯碱化工厂产生的NaOH溶液是否达到高浓度标准,进行了如下操作,请你参与计算:
(1)到工厂采集了电解槽中的NaOH溶液100g。NaOH中氧元素的质量分数是 。
(2)在实验室用如右图所示浓硫酸配制200g24.5%的稀硫酸,计算所取浓硫酸的体积 (计算结果取整数)。

(3)进行中和测定,向采集到的溶液中逐滴加入所配制的稀硫酸,并不断测定溶液的pH值,当pH=7时,消耗稀硫酸160g。通过计算判断此时电解槽中NaOH溶液是否达到高浓度标准。
查看答案和解析>>
科目: 来源: 题型:
日常使用的金属材料,大多数属于合金。黄铜是以锌作主要添加元素的铜合金。
⑴赤铜(Cu2O)是我国古代制取黄铜的一种原料。Cu2O中铜元素与氧元素的质量比是  。
。
⑵弹壳的黄铜只含有锌和铜。将22 g弹壳放在盛有100 g稀硫酸的烧杯中(硫酸足量),当弹壳不再溶解后,烧杯中混合物的质量是121. 8 g。计算:
①产生氢气的质量。
②弹壳中铜的质量。
③反应后所得溶液中ZnSO4的质量分数(计算结果保留一位小数)。
查看答案和解析>>
科目: 来源: 题型:
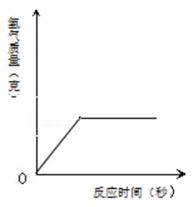
100克某浓度的硫酸恰好与13克的锌完全起反应。请计算:
⑴生成氢气的质量(结果精确到0.1g);
⑵将⑴的结果标在图中;
⑶反应后所得溶液中溶质的质量分数(写出计算过程,结果精确到0.1%).
查看答案和解析>>
科目: 来源: 题型:
某兴趣小组用图22所示装置制取氧气,试管中固体的质量随时间变化的数据见下表,制取结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到氯化钾溶液100g。
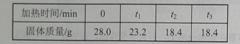
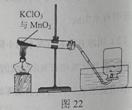
(1)共制得氧气 g。
(2)计算所得氯化钾溶液的溶质质量分数。
查看答案和解析>>
科目: 来源: 题型:
实验中学化学兴趣小组为测定某石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙的质量分数,进行如图所示的实验。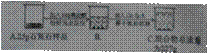
请根据以上信息计算:
(1)样品中碳酸钙的质量分数?
(2)C烧杯中溶液的溶质质量分数?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com