
科目: 来源: 题型:
将铁粉和铜粉混合物7.0g,加入到盛有60.0 g稀盐酸的烧杯中,恰好完全反应。此时烧杯内各物质的总质量为66.8 g。试计算:
(1)原混合物中铁粉的质量分数。(精 确到0.1%)
确到0.1%)
(2)反应后所得溶液中溶质的质量分数。(精确到0.1%)
查看答案和解析>>
科目: 来源: 题型:
化学实验是进行科学探究的重要方式。
(1)下列实验仪器中不能用于加热的是____(填字母代号)。
a.烧杯 b.量筒 c.试管 d.蒸发皿
(2)某化学小组选用以下装置和药品进行探究实验。
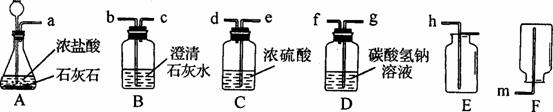 ①A中反应的化学方程式为___________________________________________________。
①A中反应的化学方程式为___________________________________________________。
②若将A、B连接,A中产生的气体并不能使B中的溶液变浑浊,这是为什么?
③若要制取一瓶较为纯净、干燥的CO2,所选用装置的导管接口从左到右的正确连接
顺序为:a接________、_________接________、________接________。
(3)为探究工业废水的综合利用,某化学小组在实验室中完成了以下实验。
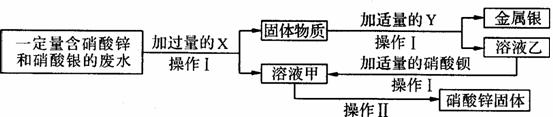 ①X为____;乙与硝酸钡反应的化学方程式为_____________________________________。
①X为____;乙与硝酸钡反应的化学方程式为_____________________________________。
②操作I和操作Ⅱ中都要用到一种玻璃仪器。该仪器在操作Ⅱ中的作用是什么?
(4)某工厂变废为宝,探究用废硫酸等来制取所需产品。现有废硫酸4.9 t(H2SO4的
质量分数为20%),与足量废铁屑反应来制取硫酸亚铁,同时将生成的全部氢气通入足量
氧化铜中并加热(H2+CuO == Cu +H2O),请计算理论上最多可生产铜的质量。
查看答案和解析>>
科目: 来源: 题型:
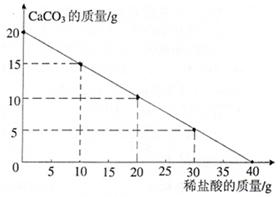
向20g CaCO3中不断地加入稀盐酸,其变化图像如右图所示。请回答以下问题:(1)当20g CaCO3完全反应时,所加稀盐酸的质量为 g。
(2)求所加稀盐酸的溶质质量分数为多少?
(写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
中和反应在工农业生产中应用广泛。现向40 g10%的氢氧化钠溶液中不断滴加盐酸,同时测定溶液pH的变化(曲线见右图)。请分析计算:
(1)40g10%的氢氧化钠溶液中含有 ▲ g氢氧化钠;
当滴入36.5 g盐酸时,溶液的pH为 ▲ 。
(2)所用盐酸的溶质质量分数(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
兴趣小组的同学为测定某一铁铜合金中含铁的质量分数,将6g该合金粉末样品,加入溶质质量分数为10%的硫酸铜溶液160g中,二者恰好完全反应。同时为了充分利用资源,还对反应后的物质进行回收处理。请结合下列图示计算:
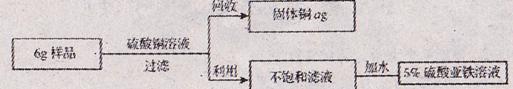
(1)该合金样品中含铁的质量分数;(计算结果精确至0.1%)
(2)所的固体铜的质量a为多少g?
(3)向不饱和滤液中加入多少g水,能得到5%的硫酸亚铁溶液,用于花卉的营养液,计算结果精确至0.1g。
查看答案和解析>>
科目: 来源: 题型:
钙是维持人体正常功能所必须的元素,有时需要服用补钙满足人体需求。下图分别为两种补钙剂说明书的一部分。

请根据图示中的信息回答下列问题:
(1)钙是人体必须的常量元素,每日要摄取足量的钙,才能避免 (填字母序号);
A.佝偻病或骨质疏松 B.贫血症 C.甲状腺肿大
(2)葡萄糖酸钙(C12H22O14Ca)的化学式量是 ;
(3)碳酸钙(化学式为CaCO3)中钙元素的质量分数为 ;
(4)每片金钙尔奇中含碳酸钙的质量为  mg;
mg;
(5)按照金钙尔奇说明书每日的补钙量,若该服用葡萄糖酸钙片,一日3次,一次应服用几片? 。
查看答案和解析>>
科目: 来源: 题型:
下列三套装置都能用于实验室制取二氧化碳
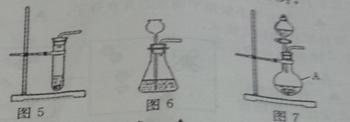
(1)写出实验室制取二氧化碳的化学方程式:____________________,
(2)仪器A的名称是__________________
(3)利用图6装取制取二氧化碳时,长颈漏斗的下端管口必须浸没在溶液中,理由是_____________,
(4)图5和图7装置相比.利用图5装置来制取二氧化碳,时主要的不足是_______(写一条即可)
(5)化学兴趣小组为了测定石灰石样品中碳酸钙的质量分数,取一定量的石灰石样品,将20g稀盐酸分4次加人样品中(样品中除碳酸钙外,其余成分不与盐酸反应,也不溶 于水).充分反应后经过过滤、千操等操作,最后称量,数据如下表
| 稀盐酸的用量 | 剩余固体的质量 |
| 第一次加入5g | 1.5g |
| 第二次加入59 | 1.0g |
| 第三次加入59 | 0.5g |
| 第四次加入59 | 0.3g |
①石灰石样品中碳酸钙的质量分数为_________________
②原稀盐酸中溶质的质量分数为多少?(写出计其过程)
查看答案和解析>>
科目: 来源: 题型:
硫酸是化工生产中重要的酸,其产量最大,用途最广,消耗量最多。历史上曾将硫酸的产量或消耗量作为一个国家化工生产发达程度的标志。
浓硫酸具有吸水性、脱水性和强氧化性。浓硫酸的腐蚀性主要是由它的脱水性和强氧化性引起的。稀硫酸有强酸性,稀硫酸的腐蚀性则主要是由酸性及水分蒸发后变浓而产生的。
 硫酸的用途极广,常用于生产化肥、冶炼金属、农药、制药等。
硫酸的用途极广,常用于生产化肥、冶炼金属、农药、制药等。
工业制硫酸的流程为:FeS2 SO2 SO2 H2SO4
(1)综合分析以上材料,并结合已有知识,请回答:
①工业制H2SO4可能会引起的环境问题是 。
②在实验室中不慎将浓硫酸 沾到皮肤上的处理方法是 。
沾到皮肤上的处理方法是 。
A.立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液。
B.立即用稀氢氧化钠溶液冲洗,然后再用水冲洗。
(2)某工厂化验室用9.8%的稀硫酸洗涤一定量化工产品中残留Ba(OH)2,当消耗稀硫酸100g时,沉淀不再产生,问此时液体的pH= 7 (不考虑其它物质的影响),求化工产品中残留Ba(OH)2的质量。
查看答案和解析>>
科目: 来源: 题型:
二氧化碳是一种宝贵的碳氧资源。以C02和NH3合成尿素CO(NH2)2是固定和利用C02的成功范例,该反该反应的化学方程式为CO2+2NH3=CO(NH2)2,+H20 。请计算:
。请计算:
(1)尿素中C、0、N、H四种元素的质量比(直接写出答案)。
(2)若按上述方法生产120t尿素,可固定的C02的质量为多少。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com