
科目: 来源: 题型:
课外活动时,同学们采用以下两种方法测定某氯化钠溶液的溶质质量分数。
(1)【化学方法】向一定量氯化钠溶液中加入足量硝酸银溶液,得到2.87g氯化银固体,则该氯化钠溶液中氯化钠的质量为多少?(根据化学方程式列式计算)
经多次实验测定,该溶液的溶质质量分数为10%。
(2)【物理方法】取一定量该溶液进行蒸发,测量实验数 据如下:
据如下:
| 蒸发皿的质量(g) | 25.0 |
| 蒸发皿+食盐溶液(g) | 45.0 |
| 蒸发皿+食盐晶体(g) | 27.4 |
| 数据处理 | 溶液的溶质质量分数为 |
若化学方法测定结果准确,则物理方法测定结果产生误差的原因是
A.蒸发时未用玻璃棒搅拌
B.所取氯化钠溶液质量较大
C.蒸发时出现少量晶体时就停止加热
D.实验后未将玻璃棒上的白色固体移入蒸发皿
查看答案和解析>>
科目: 来源: 题型:
某校化学兴趣小组用一瓶含有少量氯化钠的硫酸钠固体样品,进行如图所示的实验

请跟据以上信息计算(结果保留到小数点后两位)
(1)反应生成沉淀的质量为 g。
(2)样品中硫酸钠的质量。
(3)求滤液中氯化钠的质量分数。
查看答案和解析>>
科目: 来源: 题型:
为测定锌铜合金中锌的含量,取该合金放入如图 14 盛有稀硫酸的锥形瓶中,发生反应: Zn+H2SO4=ZnSO4+H2↑。多次实验后,取平均值所得数据如下表:

| 反应前 | 充分反应后装置及反应剩余物质质量 | |
| 装置和足量的稀硫酸质量 | 锌铜合金质量 | |
| 342.10g | 16.00g | 357.70g |
若不考虑干燥剂吸收空气中的水蒸气,计算:
(1)根据质量守恒定律求生成氢气的质量。
(2)该合金中锌的质量分数。
查看答案和解析>>
科目: 来源: 题型:
某石灰厂需要测定产品生石灰中杂质(杂质只含CaCO3)的质量分数。小刚进行了如图实验。请计算:

(1)生成CO2气体的质量;
(2)样品中CaCO3的质量分数。
查看答案和解析>>
科目: 来源: 题型:
利用沉淀法可测定某粗盐样品的纯度(假定粗盐中的杂质全部是MgCl2).每次取1000g样品配制成溶液,向其中加入10%的氢氧化钠溶液,测得生成沉淀的质量与所加氢氧化钠溶液的质量关系如下表所示:
| 测定次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 样品质量(g) | 1000 | 1000 | 1000 | 1000 |
| 氢氧化钠溶液质量(g) | 320 | 640 | 820 | 900 |
| 沉淀质量(g) | 23.2 | 46.4 | 58 | 58 |
(1)求粗盐的纯 度(写出解题过程).
度(写出解题过程).
(2)当样品与所加氢氧化钠溶液恰好完全反应时溶液中氯化钠的质量为 .
查看答案和解析>>
科目: 来源: 题型:
硅钢是变压器、充电器中的核心材料,其主要成份是Fe和Si。某学生用硅钢样品做了如下实验:取4.2g硅钢样品,将60g稀硫酸分6次加入样品中(其中稀硫酸与硅及其它杂质不反应),充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
| 稀硫酸的用量 | 剩余固体的质量 |
| 第一次加入10g | mg |
| 第二次加入10g | 2.8g |
| 第三次加入10g | 2.1g |
| 第四次加入10g | 1.4g |
| 第五次加入10g | 0.7g |
| 第六次加入10g | 0.7g |
(1)从以上数据可知,稀硫酸加入第 次充分反应后,铁恰好完全反应。
(2)表格中m= 。
(3)计算所用稀硫酸中溶质的质量分数。
查看答案和解析>>
科目: 来源: 题型:
某氢氧化钠样品中含有少量的碳酸钠杂质.现取21.3g样品于烧杯中,加入173.4g水使其完全溶解,再向其中逐滴加入稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如图所示,请计算:
(1)样品中氢氧化钠的质量.
(2)B点时,烧杯内溶液的溶质质量分数.

查看答案和解析>>
科目: 来源: 题型:
某兴趣小组用图22所示装置制取氧气,试管中固体的质量随时间变化的数据见下表。制取结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到氯化钾溶液100g。
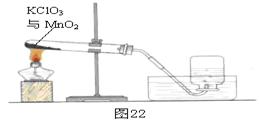
| 加热时间/min | 0 | t1 | t2 | t3 |
| 固体质量/g | 28.0 | 23.2 | 18.4 | 18.4 |
(1)共制得氧气 g。
(2)计算所得氯化钾溶液的溶质质量分数。
查看答案和解析>>
科目: 来源: 题型:
某化学兴趣小组提出可以用含铜废料制备蓝色胆矾(CuSO4·XH2O)。
查阅资料:Ⅰ.过氧化氢在常温下会缓慢分解为氧气和水。对其水溶液加热 、光照或加催化剂(如MnO2)都会促进其分解。
、光照或加催化剂(如MnO2)都会促进其分解。
Ⅱ.CuSO4·XH2O易溶于水、难溶于酒精,加热时会逐步失去结晶水,最终生成CuSO4。
Ⅲ.白色粉末CuSO4易与水化合生成CuSO4·XH2O。
I、硫酸铜晶体的制备
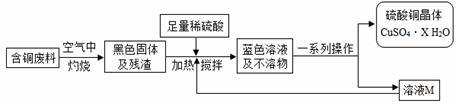 方案1:甲同学根据已学知识,提出了制备硫酸铜方案:
方案1:甲同学根据已学知识,提出了制备硫酸铜方案:
 方案2:乙同学查阅资料归纳出一种工业制备硫酸铜的流程:
方案2:乙同学查阅资料归纳出一种工业制备硫酸铜的流程:
(1)上述方案1中加热搅拌的作用是 ▲ ,形成蓝色溶液的反应化学方程式是 ▲ 。
(2)方案2中,加入H2O2后要求温度控制在50℃到60℃是为了防止 ▲ 。
(3)从环保角度对两套方案的不同部分进行比较,你认为方案 ▲ (填“1”或“2”)更合理。理由是: ▲ 。
(4)方案中“一系列操作”依次为:过滤、 ▲ 、冷却结晶、 ▲ (填序号)。
A.蒸发浓缩 B.加水稀释 C.加水溶解 D.过滤
(5)溶液M、N都 是CuSO4的 ▲ (选填“饱和”、“不饱和”或“不一定饱和”)溶液;向其中加入无水CuSO4,均会析出硫酸铜晶体,这是因为 ▲ 。
是CuSO4的 ▲ (选填“饱和”、“不饱和”或“不一定饱和”)溶液;向其中加入无水CuSO4,均会析出硫酸铜晶体,这是因为 ▲ 。
(6)所得硫酸铜晶体需要洗涤后晾干,最合适的洗涤试剂是(填序号) ▲ ,
理由是 ▲ 。
A.冷蒸馏水 B. 95%的酒精 C.热蒸馏水
II、硫酸铜晶体(CuSO4·xH2O)中结晶水(xH2O)含量的测定
 兴趣小组取12.5g硫酸铜晶体(CuSO4·xH2O)进行加热分解,获得相关数据,并绘制成固体质量与温度的关系图。
兴趣小组取12.5g硫酸铜晶体(CuSO4·xH2O)进行加热分解,获得相关数据,并绘制成固体质量与温度的关系图。
(7)258℃时,固体完全变成白色粉末。
 根据图中数据,计算CuSO4·xH2O中
根据图中数据,计算CuSO4·xH2O中
x 的值为 ▲ 。
(8)加热过程中,硫酸铜晶体分步失
去结晶水。写出45℃~110℃时
发生反应的化学方程式 ▲ 。
(9)580℃以上时,硫酸铜粉末就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
 |
请回答下列问题:
(1)物质C的化学式是 ▲ 。
(2)溶液F中一定含有的溶质是 ▲ 。
(3)反应①的化学方程式是 ▲ 。
(4)反应③的化学方程式是 ▲ 。
(5) G遇碘水变蓝色,G是含 ▲ 的食物。在人体内,G转变成葡萄糖,葡萄糖发
G遇碘水变蓝色,G是含 ▲ 的食物。在人体内,G转变成葡萄糖,葡萄糖发
生缓慢氧化的化学方程式是 ▲  。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com