
科目: 来源: 题型:
镁是一种用途很广的金属,目前世界上60%的镁是从海水(主要含NaCl和MgCl2等)中提取的.主要步骤如下:
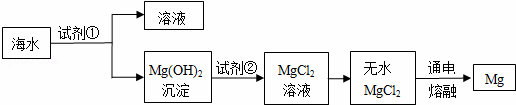
(1)上述步骤中试剂①应过量,理由是 .
(2)请写出Mg(OH)2沉淀与试剂②发生中和反应的化学方程式 .
(3)无水MgCl2在熔融状态下通电得到金属镁和物质A,氢气在物质A中燃烧生成物质B,则物质A和B的化学式分别为:A ,B .
查看答案和解析>>
科目: 来源: 题型:
工业烟气通常含有二氧化硫,在排放前需经脱硫处理.如图是两种常用脱硫工艺中含硫物质的转化路径(部分产物已略).请回答下列问题:
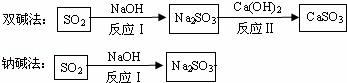
(1)反应Ⅰ的化学方程式是 .
(2)反应Ⅱ所属的基本反应类型是 ,CaSO3中Ca、S、O元素的质量比是 .
(3)已知原料NaOH的价格为2.9元/kg、Ca(OH)2的价格为0.36元/kg.两种工艺中,处理相同质量的SO2,双碱法所需的原料成本更低,其原因是 .
查看答案和解析>>
科目: 来源: 题型:
某金属冶炼厂的工业废渣中含有泥沙和某些单质,其中单质含有铜、锌和少部分硫。现欲回收铜和锌,并对硫进行
处理,主要流程如下图所示:
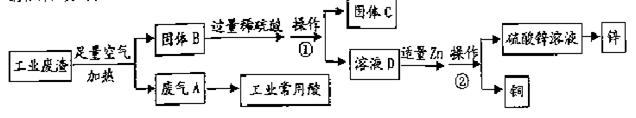 (1)在废气A中,一定含有的有害气体是 (填化学式)。操作①的操作名称是 。
(1)在废气A中,一定含有的有害气体是 (填化学式)。操作①的操作名称是 。
(2)溶液D中含有的溶质是 (填化学式)。
(3)写出加入Zn后发生的化学方程式(写出其中之一即可) 。
查看答案和解析>>
科目: 来源: 题型:
某烟气脱硫的工艺不仅能消除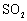 ,还能将其转化为石膏(
,还能将其转化为石膏(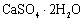 )等产品,实现“变废为宝”。主要物质转化关系如下:
)等产品,实现“变废为宝”。主要物质转化关系如下:

⑴设备1中,通过喷淋水脱去烟气中的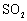 ,该反应的化学方程式为 。
,该反应的化学方程式为 。
⑵设备2中,加入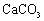 的目的是将
的目的是将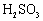 转化为 。
转化为 。
⑶设备3中,反应前后化合价发生改变的元素是 。
查看答案和解析>>
科目: 来源: 题型:
生物浸出技术在金属冶炼中应用广泛。嗜热细菌在65-80℃酸性水溶液及氧气存在下,能氧化黄铜矿(主要成分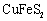 )产生硫酸盐,进而生产铜和绿矾,主要流程如下:
)产生硫酸盐,进而生产铜和绿矾,主要流程如下:
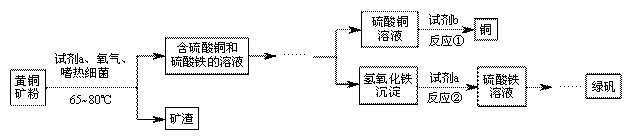
⑴分离出矿渣的操作是 。
⑵若试剂b为Fe粉,反应①的化学方程式为 。
⑶氢氧化铁与试剂a发生中和反应,反应②的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
现代循环经济要求综合考虑环境污染和经济效益。高纯氧化铁可作现代电子工业的材料,以下是用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图:[(NH4)2CO3溶液呈碱性,40 ℃以上时(NH4)2CO3分解]。
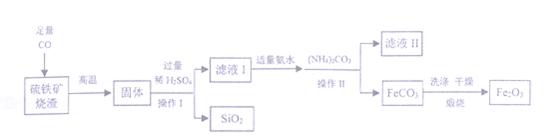
(1)实验室中,操作Ⅰ、操作Ⅱ用到的玻璃仪器有玻璃棒、烧杯、 等。
(2)滤液Ⅰ中主要的阳离子是 等。
(3)加适量氨水的目的是 。
(4)根据题中信息,加入(NH4)2CO3后,该反应必须控制的条件是 。
(5)滤液Ⅱ中可回收的产品是 (写化学式)。
(6)写出在空气中煅烧FeCO3的化学反应方程式 。
查看答案和解析>>
科目: 来源: 题型:
黄铜矿(主要万分CuFeS2)经初步处理后,所得溶液甲中的溶质为Fe2(SO4)3、CuSO4及H2SO4。某同学通过废铁屑与溶液甲反应,制取补血剂原料碳酸亚铁并回收铜。主要步骤如图7所示:


(1)Fe2(SO4)3与铁反应的化学方程式: x Fe2(SO4)3+ y Fe= z FeSO4,其中x、y、z为化学计量数,z的值为_____________。
(2)步骤Ⅰ中,生成铜的化学方程式:__________________________。
(3)步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是__________________
__________________________________。
(4)步骤Ⅱ中加入一种可溶性试剂可实现其转化,从复分解反应发生的条件分析,该试剂可以是_____________(填化学式)。
(5)步骤Ⅲ回收铜的方法为_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
绿矾又名七水硫酸亚铁(FeSO4·7H2O),其用途广泛,可用于制铁盐、氧化铁颜料、净水剂、防腐剂、消毒剂等。绿矾(FeSO4·7H2O)的一种综合利用工艺如下:
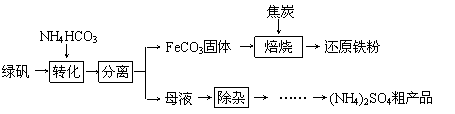
(1)细铁丝在氧气中可以燃烧,请写出铁在氧气中燃烧的化学方程式 。
(2)绿矾与NH4HCO3在溶液中反应,有CO2生成,反应的化学方程式为 。
(3) 隔绝空气进行“焙烧”,铁元素的转化途径是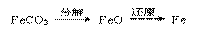 ,实际作还原剂的是CO。写出“焙烧”过程中各步反应的化学方程式:
,实际作还原剂的是CO。写出“焙烧”过程中各步反应的化学方程式:
A.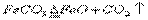 ;
;
B.____________________________________________;
C.____________________________________________。
4.母液“除杂”后,欲得到(NH4)2SO4粗产品,操作步骤依次为蒸发浓缩、____________、过滤、洗涤、干燥。
查看答案和解析>>
科目: 来源: 题型:
含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途
I.以含锌废渣(主要成分为ZnO,杂质为FeO﹑CuO)为原料制备七水硫酸锌(ZnSO4·7H2O)的流程如下。
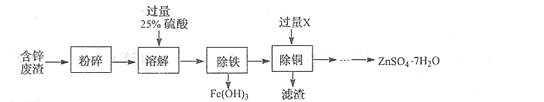
⑴粉碎的目的是 。
⑵若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要的玻璃仪器有胶头滴管﹑玻璃棒﹑ 和 ,此处玻璃棒的作用是 。
⑶物质X是 ,滤渣中含有的金属单质有 ,除铜时发生的反应属于 反应(填基本反应类型)
⑷流程中获得七水硫酸锌前省略的操作是 ﹑冷却结晶﹑ 洗涤和低温烘干。
⑸某温度下,Fe(OH)3分解得到一种铁﹑氧质量比21:8的氧化物,该氧化物的化学式 。
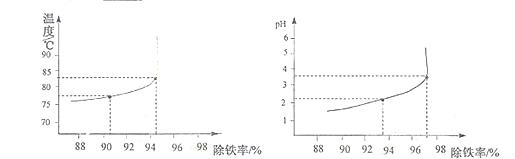
⑹除铁过程中,温度pH对除铁效果的影响分别对如图所示。由图可知,除铁时温度应控制在 ℃为宜,pH应控制在 为宜。
II.以某菱锌矿(ZnCO3含量为62.5%)为原料制备锌的原理如下(假设杂质不参加反应):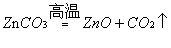
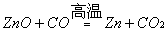 则100吨这样的菱锌矿理论上最多制得锌多少吨?(写出计算过程)
则100吨这样的菱锌矿理论上最多制得锌多少吨?(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com