
科目: 来源:2016届新人教版九年级下第一次月考(6)化学试卷(解析版) 题型:探究题
茶叶、肉松、膨化食品等常采用真空充气包装,即将食品装入包装袋,抽出包装袋内空气,再充入防止食品变质的气体,然后封口.真空充气包装能使食品保持原有的色、香、味及营养价值,防止食品受压而破碎变形.
【提出问题】充入食品包装袋中的气体是什么?
【猜想与验证】可能是氮气(N2).
实验初步验证的方法及现象:
【新的猜想】充入的气体还可能是:① ;② .
查看答案和解析>>
科目: 来源:2016届新人教版九年级下第一次月考(6)化学试卷(解析版) 题型:探究题
某同学做了“用过氧化氢(H2O2)溶液和二氧化锰(MnO2)制氧气”的实验后,展开了下列思考与探究:
(1)催化剂MnO2的用量对反应速率有没有影响呢?
他做了这样一组实验:每次均用30mL10%的H2O2溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他实验条件均相同)
实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
MnO2用量(克) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
所用时间(秒) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 | 2 | 2 |
请分析表中数据回答:MnO2的用量对反应速率有没有影响呢?如果有,是怎样影响的呢?
答: .
(2)H2O2溶液的溶质质量分数对反应速率有没有影响呢?
他又做了一组实验:每次均取5mL30%的H2O2溶液,然后稀释成不同溶质质量分数的溶液进行实验.记录数据如下:(实验均在20℃室温下进行,其他实验条件也均相同)
实验次序 | H2O2溶液溶质质量分数 | MnO2粉末用量(克) | 收集540mL气体所用时间 | 反应后液体温度(℃) |
1 | 1% | 0.2 | 660秒 | 24 |
2 | 3% | 0.2 | 220秒 | 34 |
3 | 5% | 0.2 | 205秒 | 39 |
4 | 10% | 0.2 | 80秒 | 56 |
5 | 15% | 0.2 | 25秒 | 65 |
6 | 20% | 0.2 | 9秒 | 67 |
7 | 25% | 0.2 | 4秒 | 69 |
8 | 30% | 0.2 | 3秒 | 70 |
请分析表中数据回答:H2O2溶液的溶质质量分数对反应速率有没有影响呢?如果有,是怎样影响的呢?
答: .
由表中数据还可看出,该反应是个 反应(填“放热”或“吸热”).
(3)还有哪些因素可能影响该反应的速率呢?
请说出你的一个猜想: .
查看答案和解析>>
科目: 来源:2016届浙江省金华市九年级上月考化学试卷(解析版) 题型:选择题
某电镀厂的电镀液中含有金盐,为了回收其中的金元素,技术人员制作了如图的“吸金球”,“吸金球”是装入一些“吸金”物质的纱袋,把“吸金球”浸入电镀液,能“吸”出盐溶液中的金,据上所述,“吸金球”中的“吸金”物质可能是( )

A.活性炭(C) B.磁石(主要成分是Fe3O4)
C.铁屑(Fe) D.胆矾(CuSO4•5H2O)
查看答案和解析>>
科目: 来源:2016届浙江省金华市九年级上月考化学试卷(解析版) 题型:选择题
下列实验操作能达到实验目的是( )
选项 | 实验目的 | 实验操作 |
A | 验证NaCl溶液中混有盐酸 | 取少量溶液,滴加无色酚酞溶液 |
B | 比较Fe、Cu、Ag的金属活动性 | 铁丝浸入CuSO4溶液,铜丝浸入AgNO3溶液 |
C | 除去铁制品上的铁锈 | 将铁制品长时间浸泡在足量的稀硫酸中 |
D | 除去粗盐中的难溶性杂质 | 将粗盐研碎、溶解、蒸发 |
A.A B.B C.C D.D
查看答案和解析>>
科目: 来源:2016届浙江省金华市九年级上月考化学试卷(解析版) 题型:选择题
如表列出了除去物质中所含少量杂质的方法错误的是( )
选项 | 物质 | 所含杂质 | 除去杂质的方法 |
A | N2 | O2 | 将气流通过灼热的铜网 |
B | NaCl固体 | 硫酸钠 | 溶解,加入适量BaCl2溶液,充分反应后过滤,洗涤,干燥 |
C | Cu(NO3)2溶液 | AgNO3 | 加入足量铜粉,充分反应后过滤 |
D | CaCl2溶液 | HCl | 加入足量CaCO3粉末,充分反应后过滤 |
A.A B.B C.C D.D
查看答案和解析>>
科目: 来源:2016届浙江省金华市九年级上月考化学试卷(解析版) 题型:填空题
根据化学性质不同,氧化物主要可分为酸性氧化物、碱性氧化物、两性氧化物和不成盐氧化物.能跟碱反应,生成盐和水的氧化物,叫做酸性氧化物;能跟酸反应,生成盐和水的氧化物,叫做碱性氧化物.Al2O3是一种两性氧化物,它有如下化学性质:Al2O3+6HCl═2AlCl3+3H2O;Al2O3+2NaOH═2NaAlO2+H2O
请回答下列问题:
(1)下列氧化物中,属于碱性氧化物的是 .(填字母编号)
A.H2O B.CO C.SO2 D.Fe2O3
(2)NaAlO2的名称是偏铝酸钠,它属于 (选填“酸”、“碱”、“盐”或“氧化物”)类物质.偏铝酸钠电离时产生的阴离子是 (填离子符号).
查看答案和解析>>
科目: 来源:2016届浙江省金华市九年级上月考化学试卷(解析版) 题型:填空题
某科学兴趣小组在课外活动中,对某无色透明溶液进行了多次检测,其中三次检测结果如表所示,请回答:
检测次数 | 溶液中检测出的物质 |
第一次 | KCl、K2SO4、Na2CO3、NaCl |
第二次 | KCl、BaCl2、Na2SO4、K2CO3 |
第三次 | Na2SO4、KCl、K2CO3、NaCl |
(1)三次检测结果中第 次检测结果不正确.
(2)在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子,先向溶液中加入过量的稀HNO3溶液;然后继续加入过量的 溶液;过滤后,再向滤液中加入AgNO3溶液.
(3)测得某溶液中仅含有Na+、Mg2+、SO42﹣、Cl﹣四种离子,其中离子个数比为Na+:Mg2+:Cl﹣=4:5:8.若设Na+为4n个,则SO42﹣的离子数为 .
查看答案和解析>>
科目: 来源:2016届浙江省金华市九年级上月考化学试卷(解析版) 题型:填空题
镁是一种化学性质非常活泼的金属.在点燃或加热的条件下,能跟许多物质发生反应,如:
2Mg+CO2 2MgO+C Mg+2H2O
2MgO+C Mg+2H2O Mg(OH)2+H2↑
Mg(OH)2+H2↑
(1)在点燃的条件下,镁能和氮气反应生成一种淡黄色的固体氮化镁(化学式Mg3N2),氮化镁能和水反应生成一种白色固体,同时放出有刺激性气味的气体.则:
①氮化镁和水反应生成的刺激性气体是 (写化学式).
②检验生成的气体的方法是 .
(2)小芳和小刚准备用空气为原料,利用下列装置制取少量氮化镁.请你帮助解决下列问题:

组装装置时导管口的连接顺序 (填导管口序号,每种装置只能用一次).
查看答案和解析>>
科目: 来源:2016届浙江省金华市九年级上月考化学试卷(解析版) 题型:探究题
课外探究时,某兴趣小组同学选择了“金属和酸反应快慢与什么因素有关”课题.
(1)其他条件相同,同种金属与不同质量分数的盐酸反应,反应的快慢不同.取质量相等的铝片,分别放入5%、20%的足量稀盐酸中,实验表明盐酸浓度越大,反应速率越快.如图1中Ⅰ、Ⅱ、Ⅲ是三位同学记录实验生成氢气的质量(m)与反应时间(t)的关系曲线,其中正确的是 .
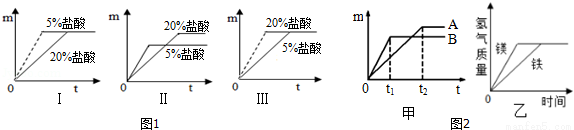
(2)其他条件相同,不同金属与相同质量分数的盐酸反应,反应的快慢不同.取质量相等的镁片、锌片、铁片中的两种金属,分别放入溶质质量分数相同的足量稀盐酸中,生成氢气的质量(m)与反应时间(t)的关系曲线如图甲所示.则曲线A对应的金属与稀盐酸反应后生成的盐的名称是 .
(3)有等质量的镁和铁,镁放入质量分数为10%的稀硫酸中,铁放入质量分数为10%的稀盐酸中,产生氢气的质量随反应时间变化曲线如图乙所示.下列结果可能的是 (填序号).
①反应后镁有剩余 ②反应后铁有剩余
③反应后稀硫酸有剩余 ④反应后稀盐酸有剩余
⑤剩余铁的和镁的质量相等 ⑥消耗的稀硫酸和稀盐酸质量相等.
查看答案和解析>>
科目: 来源:2016届浙江省金华市九年级上月考化学试卷(解析版) 题型:计算题
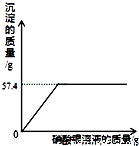
现有一种碱性调味液,是碳酸钠和氯化钠组成的溶液.为了测定碱性调味液中碳酸钠和氯化钠的质量分数,设计了如下实验方案:
【实验一】取三份碱性调味液各100g,分别缓慢加入到20g、40g和60g某盐酸中,测得三组实验数据见下表(气体的溶解忽略不计):
第1组 | 第2组 | 第3组 | |
盐酸的质量/g | 20 | 40 | 60 |
生成气体的质量/s | 2.2 | 4.4 | 5.5 |
根据实验及有关数据进行分析与计算:
(1)上述三组实验中,碳酸钠有剩余的是哪几组? ;
(2)100g碱性调味液中碳酸钠的质量为 g;
(3)100g碱性调味液与该盐酸恰好反应时,需盐酸的质量为 g,
(4)【实验二】在上述第3组反应后的溶液中滴加AgNO3溶液,绘得生成沉淀的质量随滴加AgNO3溶液质量的曲线如图.根据实验及有关数据计算碱性调味液中氯化钠的质量分数.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com