
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过滤法 | B. | 蒸馏法 | C. | 分液法 | D. | 萃取法 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  (9.5~10.5)液体肥皂 | B. |  (3.3~5.2 )菠萝汁 | ||
| C. |  (2.0~3.0)柠檬汁 | D. |  (6.5~7.5)饮用水 |
查看答案和解析>>
科目: 来源: 题型:解答题
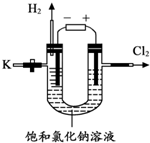 某学习小组对课本中“氯化钠能用于制烧碱”的内容产生兴趣,查阅资料得知:
某学习小组对课本中“氯化钠能用于制烧碱”的内容产生兴趣,查阅资料得知:
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com