
科目: 来源: 题型:选择题
| A. | 19% | B. | 22% | C. | 28% | D. | 20.7% |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 人体内有很多种酶,不同的酶催化体内不同的化学反应.
人体内有很多种酶,不同的酶催化体内不同的化学反应.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用稀硫酸洗去铁器上的铁锈 | |
| B. | 实验室用浓硫酸做二氧化碳气体干燥剂 | |
| C. | 用浓硫酸在白纸上写字,字迹变黑 | |
| D. | 小商贩用稀硫酸制氢气充灌氢气球 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
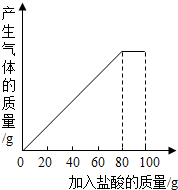 有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应,也不溶于水),得到如下部分数据和图象.
有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应,也不溶于水),得到如下部分数据和图象.| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 20 | 20 | 20 |
| 剩余固体的质量/g | 30 | a | 20 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com