
科目: 来源: 题型:多选题
| A. | 酿酒用到的酒化酶是一种催化剂 | |
| B. | 实验室制取氧气的实验中,需要用MnO2催化高锰酸钾分解 | |
| C. | 催化剂既可以是有机物,也可以是无机物 | |
| D. | 催化剂的理化性质在反应前后不发生变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 没有规定用量时,液体取1-2mL,粉末固体取一指宽 | |
| B. | 加热液体时,液体体积不能超过试管容积的三分之一 | |
| C. | 酒精灯内的酒精不能超过酒精灯容积的三分之二 | |
| D. | 量筒量取的液体体积通常应该稍小于或等于所要量取的量程 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧气易溶于水,实验室中不能用排水法收集氧气 | |
| B. | 常温常压下,氧气无色无味,化学性质比较稳定 | |
| C. | 我们周围的空气中氧气体积约占1/5,铁丝可以再纯氧中燃烧,发生氧化反应 | |
| D. | 氧气具有氧化性,物质燃烧是一种较剧烈的氧化反应,必须有氧气参与 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 水泥、钢材 | B. | 化肥、农药 | ||
| C. | 侯氏制碱法制纯碱 | D. | 海水晒盐 |
查看答案和解析>>
科目: 来源: 题型:解答题
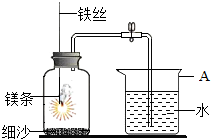 (1)如图中A仪器的名称是烧杯,燃烧,冷却后打开止水夹,水能进入集气瓶中的原因是:集气瓶中气体减少,压强减小,导致烧杯中的水进入集气瓶.
(1)如图中A仪器的名称是烧杯,燃烧,冷却后打开止水夹,水能进入集气瓶中的原因是:集气瓶中气体减少,压强减小,导致烧杯中的水进入集气瓶.查看答案和解析>>
科目: 来源: 题型:解答题
 铜钱:古代铜质辅币,俗称铜钱,黄铜在明清时期就用于铸造铜钱了,小明对铜钱(主要成分为铜和锌)中铜的质量分数产生了好奇,他称取10g铜钱样品放入烧杯中,然后往烧杯中加入稀硫酸93.5g,恰好完全反应,反应后称得烧杯内物质共103.3g.
铜钱:古代铜质辅币,俗称铜钱,黄铜在明清时期就用于铸造铜钱了,小明对铜钱(主要成分为铜和锌)中铜的质量分数产生了好奇,他称取10g铜钱样品放入烧杯中,然后往烧杯中加入稀硫酸93.5g,恰好完全反应,反应后称得烧杯内物质共103.3g.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com