
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 次数 | 1 | 2 | 3 | 4 |
| 加入盐酸质量/g | 5.0 | 5.0 | 5.0 | 5.0 |
| 剩余固体的质量/g | 1.5 | 1 | 0.5 | 0.5 |
查看答案和解析>>
科目: 来源: 题型:解答题
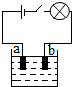 小李同学查阅资料了解到化合物根据导电性的不同,可分为电解质和非电解质两大类.其中在水溶液里或熔化状态下能够导电的化合物叫做电解质,在水溶液里或熔化状态下都不能导电的化合物叫做非电解质.于是他以食盐、硝酸钾、蔗糖、氢氧化钠和硫酸铜为材料,按下图所示的装置进行实验,实验结果记录如下表:
小李同学查阅资料了解到化合物根据导电性的不同,可分为电解质和非电解质两大类.其中在水溶液里或熔化状态下能够导电的化合物叫做电解质,在水溶液里或熔化状态下都不能导电的化合物叫做非电解质.于是他以食盐、硝酸钾、蔗糖、氢氧化钠和硫酸铜为材料,按下图所示的装置进行实验,实验结果记录如下表:| 物质 导电性 状态 | 食盐NaCl | 硝酸钾KNO3 | 蔗糖C12H22O18 | 氢氧化钠NaOH | 硫酸铜CuSO4 |
| 固态 | × | × | × | × | × |
| 熔化状态 | √ | √ | × | √ | √ |
| 水溶液 | √ | √ | × | √ | √ |
查看答案和解析>>
科目: 来源: 题型:解答题
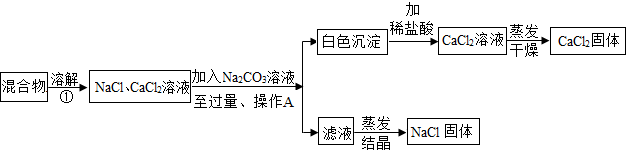
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
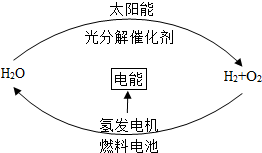
| A. | 在此循环中发生了反应:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | |
| B. | 燃料电池能够使化学反应产生的能量转化为电能 | |
| C. | 该氢能源的循环体系能够实现电能和太阳能的相互转化 | |
| D. | 目前未能使用氢气作为普通燃料的主要原因是氢气易爆炸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO2气体具有酸性 | |
| B. | CO2气体不能溶于水 | |
| C. | CO2的溶解度随着温度的升高而增大 | |
| D. | CO2水溶液在加热的情况下酸性会减弱 |
查看答案和解析>>
科目: 来源: 题型:解答题
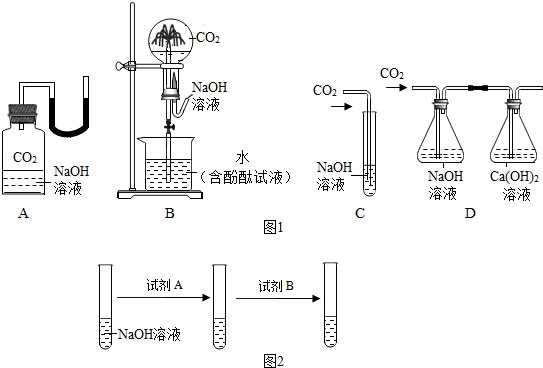
查看答案和解析>>
科目: 来源: 题型:解答题
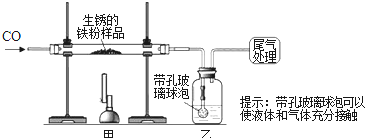
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com