
科目: 来源: 题型:解答题
 科学兴趣小组学习了二氧化锰(MnO2)催化分解过氧化氢的实验后,进行如下实验.
科学兴趣小组学习了二氧化锰(MnO2)催化分解过氧化氢的实验后,进行如下实验.| 时间/秒 | 生成氧气的体积/毫升 | |||
| 0.1克MnO2 | 0.2克MnO2 | 0.3克MnO2 | 0.4克MnO2 | |
| 40 | 49 | 61 | 75 | 86 |
| 80 | 77 | 87 | 90 | 92 |
| 120 | 89 | 92 | 92 | 92 |
| 160 | 92 | 92 | 92 | 92 |
| Fe3O4 | Fe2O3 | 铁 | |
| 分解温度/℃ | 1538 | 1400 | - |
| 熔点/℃ | - | - | 1535 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 地 块 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 施肥情况(等质量) | 尿素 (含N) | 磷酸二氢钾 (含P、K) | 磷酸二氢铵 (含N、P) | 硫酸铵 (含N) | 不施肥 |
| 小麦收获量(千克) | 55.56 | 69.26 | 56.88 | 55.44 | 55.11 |
查看答案和解析>>
科目: 来源: 题型:填空题
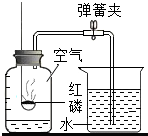 某同学用如图所示装置测定空气中氧气的体积分数,请你填写有关空格.
某同学用如图所示装置测定空气中氧气的体积分数,请你填写有关空格.查看答案和解析>>
科目: 来源: 题型:选择题
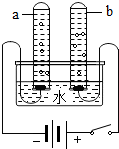 下面关于电解水实验的叙述正确的是( )
下面关于电解水实验的叙述正确的是( )| A. | 水电解的文字表达式:水→氢气+氧气 | |
| B. | 实验说明水是由氢气和氧气组成的 | |
| C. | 实验说明水是由氢、氧两种元素组成的 | |
| D. | 若a试管收集到的气体为5mL,则b试管收集到的气体为10mL |
查看答案和解析>>
科目: 来源: 题型:解答题
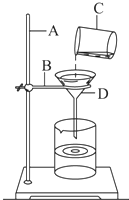 如图是某学生设计的过滤操作示意图.
如图是某学生设计的过滤操作示意图.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
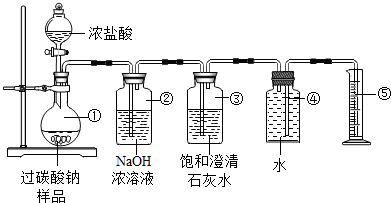
查看答案和解析>>
科目: 来源: 题型:解答题
| 序号 | 实验步骤 | 实验现象 |
| ① | 观察溶液 | 无色液体 |
| ② | 取少量该溶液于试管中,滴加紫色石蕊试液 | 紫色石蕊试液变蓝色 |
| ③ | 另取少量溶液在酒精灯火焰上灼烧 | 火焰呈现黄色 |
| ④ | 取少量该溶液于试管中,先滴加硫酸铜溶液,再滴加稀盐酸 | 先有蓝色沉淀生成,加入稀盐酸后沉淀消失,无其它明显现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com