
科目: 来源: 题型:填空题
 已知:反应①是实验室制取气体A的常用方法,D常用来改良酸性土壤,它们之间的转化关系如右图所示(部分物质和反应条件已略去).
已知:反应①是实验室制取气体A的常用方法,D常用来改良酸性土壤,它们之间的转化关系如右图所示(部分物质和反应条件已略去).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 消耗的氯化氢一样多 | B. | 碳酸镁消耗的氯化氢少 | ||
| C. | 生成的二氧化碳一样多 | D. | 碳酸氢钠生成的二氧化碳少 |
查看答案和解析>>
科目: 来源: 题型:解答题

 (注意标明二氧化碳、盐酸质量的相应数值).
(注意标明二氧化碳、盐酸质量的相应数值).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铝硬度大,不易破碎 | |
| B. | 铝不易发生化学反应 | |
| C. | 铝的氧化物容易发生氧化还原反应 | |
| D. | 铝易氧化,但铝表面的氧化物具有保护内部的铝的作用 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 块状石灰石和适量稀盐酸反应至气泡不再逸出后,测得其残留液pH 等于2.此时取反应后澄清溶液10g,逐滴匀速滴入10.6%的碳酸钠溶液,若1秒滴入0.1g碳酸钠溶液,用pH数字探测仪连续监测,得曲线如下[pH为纵坐标,时间s(秒)为横坐标]:
块状石灰石和适量稀盐酸反应至气泡不再逸出后,测得其残留液pH 等于2.此时取反应后澄清溶液10g,逐滴匀速滴入10.6%的碳酸钠溶液,若1秒滴入0.1g碳酸钠溶液,用pH数字探测仪连续监测,得曲线如下[pH为纵坐标,时间s(秒)为横坐标]:查看答案和解析>>
科目: 来源: 题型:解答题
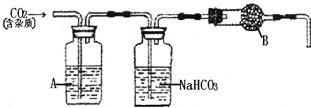
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 方案 | 实验操作 | 实验现象 | 结论 |
| 方案一 | 取少量滤液于试管中,在滤液中插入一根铜丝 | 铜丝表面无变化 | 猜想①成立 |
| 铜丝表面有银白色固体析出 | 猜想②成立 | ||
| 方案二 | 取少量滤液于试管中,滴加几 滴稀盐酸 | 滤液无明显变化 | 猜想①成立 |
| 生成白色沉淀 | 猜想②成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com