
科目: 来源: 题型:解答题
 将过量稀盐酸逐滴加入到12.5g水垢粉末中,称量下图装置6分钟内减轻的质量,结果表示如下:
将过量稀盐酸逐滴加入到12.5g水垢粉末中,称量下图装置6分钟内减轻的质量,结果表示如下:| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 减少的质量/g | 0 | 2.2 | 3.2 | 3.8 | 4.2 | 4.4 | 4.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaCl Na2SO4 | B. | NaCl HCl NaOH | ||
| C. | NaCl NaOH | D. | NaCl NaOH CaCl2 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
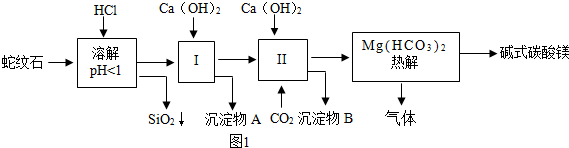
科目: 来源: 题型:解答题
| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.3 | 3.4 | 沉淀不溶 | 沉淀不溶 |
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| Mg(OH)2 | 8.6 | 11.1 | 沉淀不溶 | 沉淀不溶 |

查看答案和解析>>
科目: 来源: 题型:填空题
| 操作方法 | 实验现象 |
| 将打磨过的铝放入硫酸亚铁溶液中,观察现象 或打磨过的铁钉放入硫酸铝溶液中,观察现象 | 铝表面出现固体,溶液由浅绿色慢慢变成无色 或无明显变化 |
查看答案和解析>>
科目: 来源: 题型:填空题
 如图所示,A一D是九年级化学常见的物质.图中“→”表示转化关系,“-”表示相互能反应(部分物质和反应条件未标出).已知B、C均为氧化物,D为胃液中的主要成分.
如图所示,A一D是九年级化学常见的物质.图中“→”表示转化关系,“-”表示相互能反应(部分物质和反应条件未标出).已知B、C均为氧化物,D为胃液中的主要成分.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com