8.

水-生命之源
(1)日常生活中区分硬水和软水用肥皂水,生活中将硬水软化用加热煮沸方法.
(2)自来水厂常用二氧化氯杀菌消毒,写出二氧化氯的化学式并标出氯元素的化合价$\stackrel{+4}{Cl}$O
2(3)某养殖场欲测定水池中水的酸碱性强弱,可选用C(填序号)
A 紫色石蕊试液 B 酚酞试液 C pH试纸
(4)探究水的组成
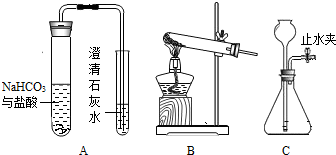
化学上用如图1装置来测定水的组成,其中a为电源的负(填“正”或“负”)极,实验时加入少量氢氧化钠来增强水的导电性,若一开始容器中水的质量为49.7g,加入0.3克的氢氧化钠完全溶解后,通电一段时间后,溶液中的溶质质量分数变为0.625%,则理论上,乙试管中可以收集到气体1.5克(精确到小数后一位),该实验得到关于水的组成的结论是水由氢元素和氧元素组成.
(5)测定水中各原子的个数比
实验室用纯净干燥的氢气还原氧化铜,并通过实验过程中相关装置中的质量变化来测定水中氢氧原子个数比,实验步骤如下:(假设每步均吸收完全,不考虑一开始装置中空气对实验结果的影响)图2
已知:①碱石灰是氢氧化钠和氧化钙的混合物,可吸收水和二氧化碳
②氢氧化铜受热分解会生成水和氧化铜
第一步:连接装置,检查装置气密性.
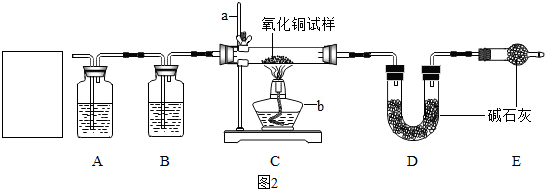
第二步:分别称得C中玻璃管和药品总质量101.6g,D中装置连同药品总质量120.0克
第三步:通一段时间的氢气,开始对C处玻璃管加热
第四步:停止加热,继续同一段时间的氢气.
第五步:再次称得C中玻璃管和药品总质量100.0克.D中装置连同药品总质量121.8克
①写出标号仪器的名称a铁架台b酒精灯
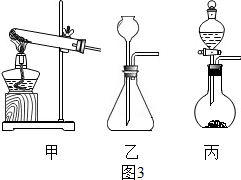
②本次实验中用锌和较浓的盐酸反应并得到持续稳定的气流,方框中应当选用的发生装置为丙(选“甲”“乙”或“丙”)其中生成氢气的化学方程式为Zn+2HCl═ZnCl
2+H
2↑
③图3A、B装置中放的药品分别为c(填序号)
a.A中饱和的碳酸氢钠溶液 B中浓硫酸
b.A中浓硫酸 B中饱和的碳酸氢钠溶液
c.A中弄氢氧化钠溶液 B中浓硫酸
d.A中浓硫酸 B中浓氢氧化钠溶液
④实验开始通一段时间的氢气,目的是除尽装置中的空气,确认此目的已经达到的实验操作方法为在E装置尾部收集气体验纯.
⑤加热一段时间后,C中发生反应的方程式为CuO+H
2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H
2O实验结束后,停止加热,继续通氢气的目的之一是让生成的铜充分冷却,另一目的为使反应生成的水被完全吸收
⑥E装置的作用为防止空气中的水蒸气和二氧化碳被D装置吸收,若无此装置,会导致实验测得的氢氧个数比偏大(填“偏大”“偏小”或“无影响”)
⑦计算该实验方法测得的氢氧个数比为2:1(含计算过程)
⑧实验反思,下列情况不会影响实验过程中氢氧原子个数比测定的是AB(填序号)
A.氧化铜没有全部被还原 B.氧化铜中混有杂质氧化铁
C.氧化铜未完全干燥 D.氧化铜中混有少量氢氧化铜
⑨若本次实验中,参加反应的氢气只占实验所需氢气量的五分之一,则完成此实验至少需要纯度为80%的粗锌多少克(杂质不与酸反应)

 水-生命之源
水-生命之源