
科目: 来源: 题型:解答题
| 实验次数 | 氧化铜/g | 硫酸溶液/g | 硫酸铜/g |
| 1 | 2.0 | 120 | 4.0 |
| 2 | 4.0 | 120 | 8.0 |
| 3 | 6.0 | 120 | 9.6 |
| 4 | 8.0 | 200 | 16 |
| 5 | 10.0 | 200 | X |
查看答案和解析>>
科目: 来源: 题型:解答题
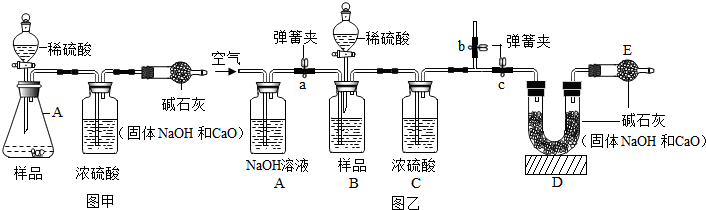
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 如图是某保健品标签的部分内容,服用该保健品后,有时会出现腹胀、打嗝等反应,出现这种反应的原因是CaCO3+2HCl=CaCl2+H2O+CO2↑(用化学方程式表示).
如图是某保健品标签的部分内容,服用该保健品后,有时会出现腹胀、打嗝等反应,出现这种反应的原因是CaCO3+2HCl=CaCl2+H2O+CO2↑(用化学方程式表示).查看答案和解析>>
科目: 来源: 题型:解答题
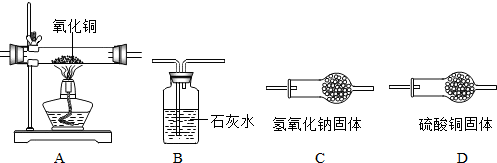
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
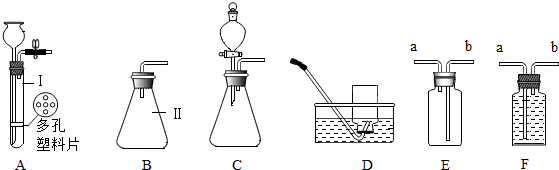
| 1号瓶 (收集34%的氧气) | 2号瓶 (收集35%的氧气) | 3号瓶 (收集36%的氧气) | 4号瓶 (收集37%的氧气) |
| 不复燃 | 不复燃,但很亮 | 很亮,复燃 | 立即复燃 |
查看答案和解析>>
科目: 来源: 题型:解答题
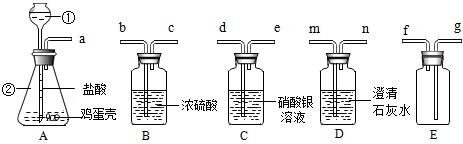
查看答案和解析>>
科目: 来源: 题型:解答题
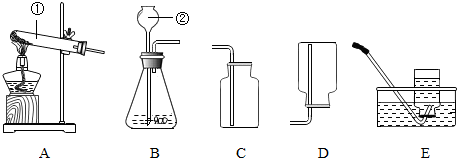
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | HCl+NaOH═NaCl+H2O | D. | Cu+2AgNO3═2Ag+Cu(NO3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com