
科目: 来源: 题型:选择题
| A. | 提出了元素周期律 | |
| B. | 首次较准确的测定了空气中氧气的体积含量 | |
| C. | 揭示了燃烧的本质 | |
| D. | 提取了治疟药物青蒿素 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
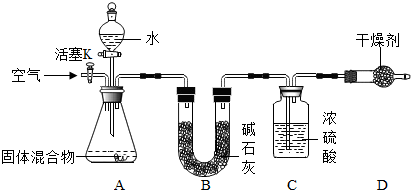
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验序号 | 稀盐酸的用量/g | 剩余固体的质量/g |
| 第一次 | 20 | 10 |
| 第二次 | 20 | 5 |
| 第三次 | 20 | 3 |
| 第四次 | 20 | m |
查看答案和解析>>
科目: 来源: 题型:解答题
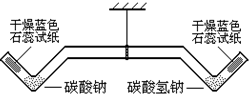 西园中学化学兴趣小组在老师指导下,对碳酸钠、碳酸氢钠的性质作进一步探究.
西园中学化学兴趣小组在老师指导下,对碳酸钠、碳酸氢钠的性质作进一步探究.| 实验现象 | 实验结论 | |
| ①用酒精灯加热左端的碳酸钠2min | 长柄双V管保持水平,干燥的蓝色石蕊试纸不变色 | 碳酸钠受热不分解 |
| ②再加热右端的碳酸氢钠2min | 长柄双V管右端上升,干燥的蓝色石蕊试纸变成红色 | 碳酸氢钠受热分解成碳酸钠等物质,有关的化学方程式是2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在NaCN中,碳、氮元素的化合价分别是+4、-3 | |
| B. | NaCN溶液的pH>7,说明该溶液中含有大量的OH- | |
| C. | 存有NaCN的仓库发生火灾,不能用水或CO2扑灭 | |
| D. | 处理含有98 gNaCN的污染源,至少需要355 gCl2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 不同年龄段的群体每天钙的适宜摄入量不同,哺乳期妇女每日推荐摄入量为1200mg,如图为某保健品说明书的一部分,请回答:
不同年龄段的群体每天钙的适宜摄入量不同,哺乳期妇女每日推荐摄入量为1200mg,如图为某保健品说明书的一部分,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com