
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 |
| ① 取少量剩余固体于试管中,加水振荡,过滤 取滤液滴加无色酚酞溶液 | 溶液变红 | 猜想Ⅲ成立 |
| ② 取滤液滴加稀盐酸 | 有气泡产生 |
查看答案和解析>>
科目: 来源: 题型:解答题
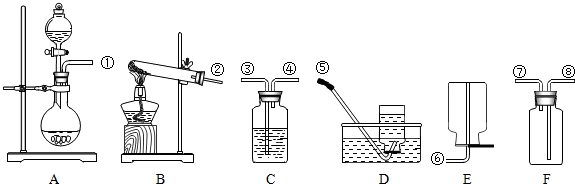
查看答案和解析>>
科目: 来源: 题型:解答题
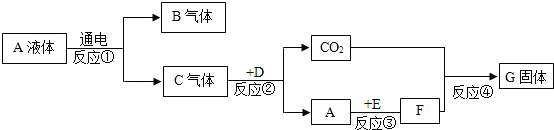
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
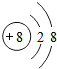 e
e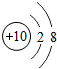
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
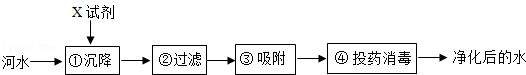
查看答案和解析>>
科目: 来源: 题型:解答题
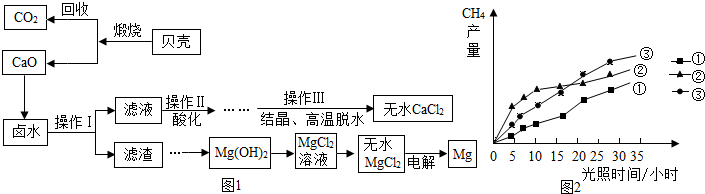
| AgNO3 | Ba(NO3)2 | AgCl | BaCl2 | |
| H2O(1) | 170g | 92.0g | 1.50×10-4g | 33.3g |
| NH3(1) | 86.0g | 97.2g | 0.80g | 0.00g |
查看答案和解析>>
科目: 来源: 题型:解答题

| 操作 | 现象 | 解释或结论 |
| ①取少量固体于试管中,加适量水振荡,用手触摸 试管外壁;静置,滴入 几滴无色酚酞试液 | 试管外壁发烫; 酚酞试液变红色. | 说明剩余固体中含有氧化钙.氧化钙 溶于水生成氢氧化钙,同时放出(填“放出”或“吸收”)热量. |
| ②再取少量固体于另一 试管中滴加过量稀盐酸 | 试管中有气泡产生 | 说明剩余固体中含有碳酸钙. |
| 时间 | 称量项目 | 质量/g |
| 反应开始前 | 装置+稀盐酸+试样 | 171.0 |
| 反应结束后 | 装置+稀盐酸+试样 | 166.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com