
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②①③ | B. | ②③① | C. | ③②① | D. | ③①② |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁、锌、钙等微量元素能调节新陈代谢,维持身体健康 | |
| B. | 食用牡蛎等含锌海产品防治因缺锌引起的食欲不振、发育不良 | |
| C. | 食品添加剂和保健药剂能适当补充一些体内缺乏的元素,可以适当食用 | |
| D. | 用甲醛浸泡水产品,会破坏蛋白质的结构,使其变质,应禁止使用 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:填空题


查看答案和解析>>
科目: 来源: 题型:解答题
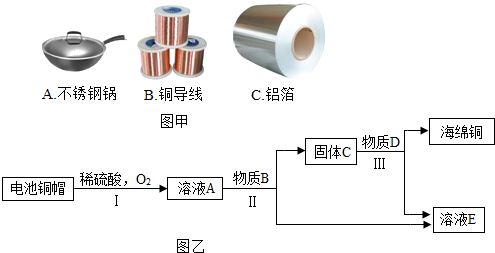
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com