
科目: 来源: 题型:选择题
| A. | 用硫酸熏蒸银耳使其雪白光鲜好看 | |
| B. | 食品中添加大量防腐剂以延长其保质期 | |
| C. | 奶茶中加入塑化剂使其口感更香醇 | |
| D. | 食用“加铁酱油”有利于预防缺铁性贫血 |
查看答案和解析>>
科目: 来源: 题型:解答题
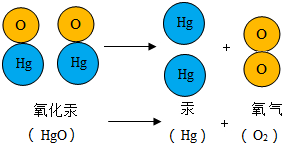 1774年,拉瓦锡用精确的定量实验研究了氧化汞分解反应中各物质质量之间的变化关系,如图是氧化汞分子分解的示意图.
1774年,拉瓦锡用精确的定量实验研究了氧化汞分解反应中各物质质量之间的变化关系,如图是氧化汞分子分解的示意图.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
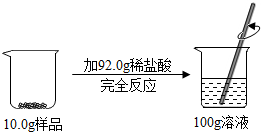 某样品由氧化铜和铜组成,取10.0g该样品于烧杯中,向其中加入92.0g稀盐酸,恰好完全反应,最终所得溶液质量为100.0g.(化学反应方程式为:CuO+2HCl═CuCl2+H2O)
某样品由氧化铜和铜组成,取10.0g该样品于烧杯中,向其中加入92.0g稀盐酸,恰好完全反应,最终所得溶液质量为100.0g.(化学反应方程式为:CuO+2HCl═CuCl2+H2O)查看答案和解析>>
科目: 来源: 题型:解答题
 某研究性学习小组在探究“锌与硫酸反应快慢的影响因素”时,发现一个意外现象,硫酸中混有硫酸铜溶液时,产生氢气的速率更快.
某研究性学习小组在探究“锌与硫酸反应快慢的影响因素”时,发现一个意外现象,硫酸中混有硫酸铜溶液时,产生氢气的速率更快.| 编号 | 20%的硫酸各20ml | 锌粒 | 收集1瓶氢气所需的时间 |
| ① | 加入质量分数为10%的硫酸铜溶液1ml | 1g | 2分10秒 |
| ② | 加入质量分数为10%的硫酸锌溶液1ml | 1g | 3分01秒 |
| 编号 | 实验步骤 | 实验现象比较 | 实验结论 |
| ① | 取1g锌粒于锥形瓶中,加入20ml20%的稀硫酸 | ②中反应速率比①快 | 产生氢气的速率较快与铜单质有关 |
| ② | 取1g锌粒于锥形瓶,加入少量铜,再加入20mL20%的稀硫酸 |
查看答案和解析>>
科目: 来源: 题型:解答题
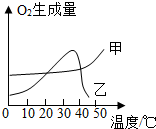 实验室常用二氧化锰催化分解过氧化氢的方法制取氧气,请写出反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.某同学从课外读物中得知新鲜的动物肝脏中有较多的过氧化氢酶,过氧化氢酶与无机催化剂Fe3+都可以催化过氧化氢分解.
实验室常用二氧化锰催化分解过氧化氢的方法制取氧气,请写出反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.某同学从课外读物中得知新鲜的动物肝脏中有较多的过氧化氢酶,过氧化氢酶与无机催化剂Fe3+都可以催化过氧化氢分解.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
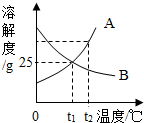 如图是A、B两种固体物质的溶解度曲线,下列说法正确的是( )
如图是A、B两种固体物质的溶解度曲线,下列说法正确的是( )| A. | A、B两种物质的溶解度都随温度升高而增大 | |
| B. | t2℃,A饱和溶液中的溶质质量大于B饱和溶液中的溶质质量 | |
| C. | A、B两种物质的溶解度均为25g | |
| D. | 升高温度可使接近饱和的B溶液变为饱和溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com