
科目: 来源: 题型:解答题
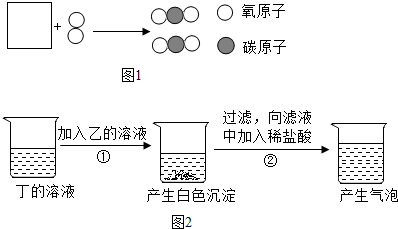
查看答案和解析>>
科目: 来源: 题型:解答题
| 清洁剂 |  彩漂液 |  洁厕灵 |  管道通 |
| 功 能 | 漂洗衣物,使色彩鲜艳 | 清除污垢,除异味 | 官道疏通,防堵塞 |
| 有效成分 | 过氧化氢 | 盐酸(HCl) | 氢氧化钠 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验探究题
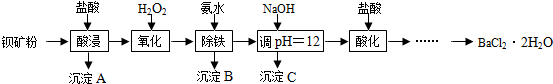
查看答案和解析>>
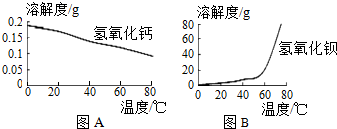
科目: 来源: 题型:实验探究题
| 温度 | 20℃ | 25℃ | 50℃ | 75℃ | 95℃ |
| 溶解度 | 0.17g | 0.35g | 0.95g | 2.2g | 6.8g |
查看答案和解析>>
科目: 来源: 题型:解答题
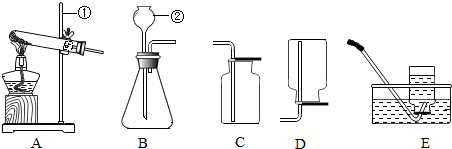
查看答案和解析>>
科目: 来源: 题型:实验探究题
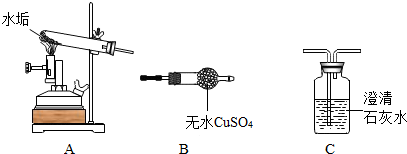

查看答案和解析>>
科目: 来源: 题型:填空题
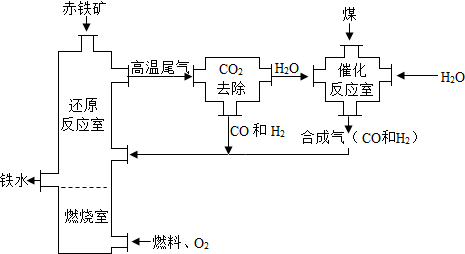
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com