
科目: 来源: 题型:解答题
 同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.
同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.| NaHCO3溶液 | NaOH溶液 | Na2CO3溶液 | |
| 加入稀盐酸 | 现象Ⅰ | 无明显变化 | 产生气泡 |
| 加入澄清石灰水 | 溶液变浑浊 | 无明显变化 | 现象Ⅱ |
| 加入CaCl2溶液 | 无明显变化 | 溶液变浑浊 | 溶液变浑浊 |
| 加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水 变浑浊 | 澄清石灰水 无明显变化 | 澄清石灰水 无明显变化 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 1926年,我国著名化学家侯德邦先生创立了侯氏制碱法,促进了世界制碱技术的发展,该方法是以从海水中提取出来的食盐为主要原料制取纯碱.其生产过程中有下列反应:
1926年,我国著名化学家侯德邦先生创立了侯氏制碱法,促进了世界制碱技术的发展,该方法是以从海水中提取出来的食盐为主要原料制取纯碱.其生产过程中有下列反应:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含有氧元素的化合物一定是氧化物 | B. | 闻到花香是因为分子在不断运动 | ||
| C. | 增大氧气的浓度能促进可燃物燃烧 | D. | 化学反应通常伴随着能量的变化 |
查看答案和解析>>
科目: 来源: 题型:解答题
 有一化学工厂排放的废水中含有碳酸钠和氢氧化钠,化学兴趣小组为探究废水中碳酸钠的含量,提取50g废水样品于锥形瓶中,逐滴加入7.3%的稀盐酸,反应过程中产生二氧化碳的质量与加入稀盐酸的质量如图,请计算.
有一化学工厂排放的废水中含有碳酸钠和氢氧化钠,化学兴趣小组为探究废水中碳酸钠的含量,提取50g废水样品于锥形瓶中,逐滴加入7.3%的稀盐酸,反应过程中产生二氧化碳的质量与加入稀盐酸的质量如图,请计算.查看答案和解析>>
科目: 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 |
| ①往第3支试管中滴加足量的氯化钙或氯化钡溶液 | 产生白色沉淀 | 其中含有碳酸钠 |
| ②静置,取上层清液,滴加1~2滴无色酚酞试液 | 无变化 | 其中不含氢氧化钠 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
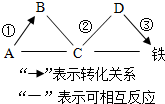 A、B、C、D分别为氧化铁、盐酸、氢氧化钙、碳酸钙中的一种,它们之间的反应或转化关系如图(部分物质和反应条件已略去).其中说法不正确的是 ( )
A、B、C、D分别为氧化铁、盐酸、氢氧化钙、碳酸钙中的一种,它们之间的反应或转化关系如图(部分物质和反应条件已略去).其中说法不正确的是 ( )| A. | 反应②中所得溶液呈浅绿色 | |
| B. | 反应③中D物质可发生还原反应得到铁 | |
| C. | C物质是盐酸 | |
| D. | 反应①的化学方程式可以是:CO2+Ca(OH)2═CaCO3↓+H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
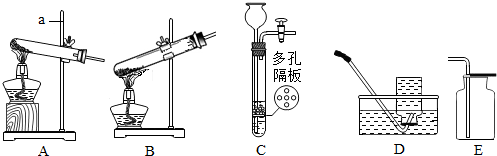
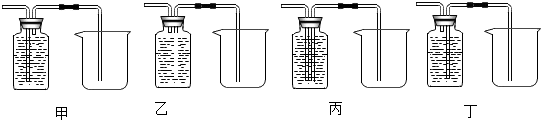
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 验证石蜡在氧气中燃烧的产物,所需氧气可用排水法收集 | |
| B. | 向NaOH固体中加入稀HCl,验证中和反应放热 | |
| C. | 证明CO2与NaOH溶液反应,只要向反应后的溶液中滴加酚酞试液 | |
| D. | 用FeCl2溶液、Cu、AgNO3溶液可以证明铁、铜、银三种金属的活动性强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com