
科目: 来源: 题型:选择题
| A. | 向H2SO4溶液中滴加Ba(OH)2溶液 | B. | 向NaOH溶液中通入CO2 | ||
| C. | 向滴有酚酞的NaOH溶液中滴加盐酸 | D. | 将(NH4)2SO4和熟石灰混合研磨 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验装置 | 实验操作 | 实验现象 |
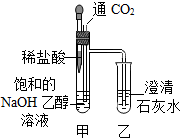 | ①向饱和的NaOH乙醇溶液中缓慢通入CO2 | 甲中出现胶状白色沉淀,乙中无明显现象 |
| ②滴入稀盐酸 | 甲中有气泡生成,乙中澄清石灰水变浑浊 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验装置 | 实验操作 | 实验现象 |
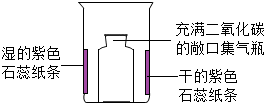 | ①在烧杯内壁上贴上干的和用水润湿的紫色石蕊纸条 ②将充满二氧化碳的敞口集气瓶轻轻放入烧杯中 | 一段时间后,湿的紫色石蕊纸条变为红色 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
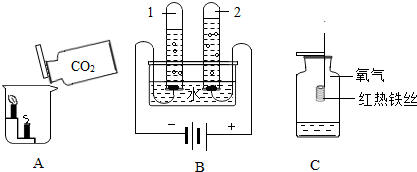
| 实验装置 | 实验操作 | 实验现象 |
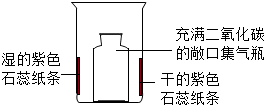 | ①在烧杯内壁上贴上干的和用水润湿的紫色石蕊纸条 ②将充满二氧化碳的敞口集气瓶轻轻放入烧杯中 | 一段时间后,湿的紫色石蕊纸条变为红色 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
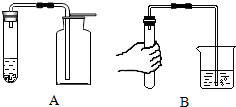 根据下图回答问题.
根据下图回答问题.查看答案和解析>>
科目: 来源: 题型:填空题
 物质由元素组成,请根据H、C、O、Cl、Ca、Na、Fe七种元素回答下列问题.
物质由元素组成,请根据H、C、O、Cl、Ca、Na、Fe七种元素回答下列问题.| 物质 | A | B |
| 滴加的物质 | 稀盐酸 | 稀盐酸 |
| 现象 | 生成浅绿色溶液和一种可燃性气体 | 生成黄色溶液 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 时间/h | 2 | 4 | 6 | 8 | 10 | 12 | 24 |
| 实验1 | 不褪色 | 不褪色 | 不褪色 | 由稍褪色到褪色且速度逐渐加快 | |||
| 实验2 | 不褪色 | 不褪色 | 不褪色 | 不褪色 | 不褪色 | 褪色且速度加快 | |
查看答案和解析>>
科目: 来源: 题型:填空题
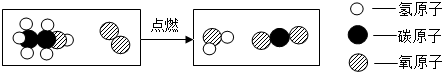
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com