
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
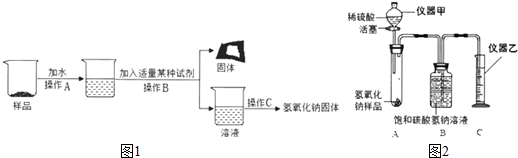
查看答案和解析>>
科目: 来源: 题型:解答题
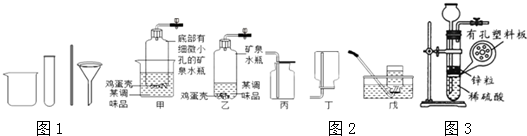
查看答案和解析>>
科目: 来源: 题型:解答题
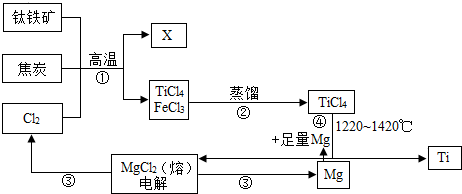
查看答案和解析>>
科目: 来源: 题型:解答题
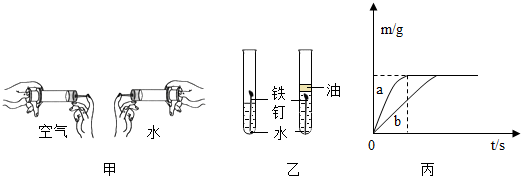
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④ | B. | ④①③② | C. | ③①④② | D. | ①②④③ |
查看答案和解析>>
科目: 来源: 题型:解答题
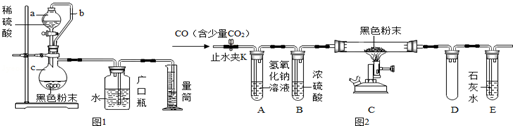
查看答案和解析>>
科目: 来源: 题型:解答题
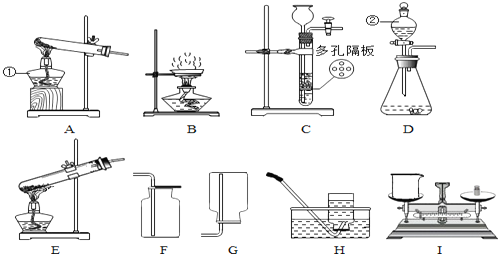
查看答案和解析>>
科目: 来源: 题型:选择题
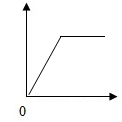 下列各选项与右图所示曲线相符的是( )
下列各选项与右图所示曲线相符的是( )| 选项 | 横坐标 | 纵坐标 |
| A | 向一定量稀硫酸中加入锌粉的质量 | 溶液中氢元素的质量 |
| B | 向一定量的氢氧化钠和碳酸钠混合溶液中加入稀盐酸的质量 | 产生气体的质量 |
| C | 向一定量的澄清石灰水中加入碳酸钠溶液的质量 | 生成沉淀的质量 |
| D | 在一定温度下,向一定量的不饱和硝酸钾溶液中加入硝酸钾固体的质量 | 溶液中溶质的质量分数 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 试管 | A | B | C | D |
| 镁条长度 | 1cm | 2cm | 3cm | 4cm |
| 不溶物 | 无 | 少量 | 较多 | 很多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com