
科目: 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量剩余溶液,滴入氯化铜溶液 | 产生蓝色絮状沉淀 | 溶液中含有氢氧化钠 |
| ②将①中反应后混合物过滤,向滤液中加入足量稀硝酸再滴入几滴硝酸银溶液 | 产生白色沉淀 | 溶液中含有氯化钠 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 物质(括号内为杂质) | 杂质 | 除杂的试剂和方法 |
| A | NaOH溶液(Na2SO4) | 过量的Ba(OH)2溶液 | 过滤 |
| B | KCl(MnO2) | 水 | 溶解、过滤、洗涤干燥 |
| C | CO(CO2) | 足量氢氧化钠溶液 | 通入并干燥 |
| D | NaCl溶液(Na2CO3) | 足量稀盐酸 | 蒸发 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在雾霾治理过程中,可注重空气中氨气的检测及控制氨气的排放 | |
| B. | PM2.5专用口罩中使用了活性炭,是利用了活性炭的吸附性 | |
| C. | 为有效控制雾霾,应禁止使用氮肥 | |
| D. | 该反应原理中所有元素化合价都不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 恰好变为无色时溶液中的溶质除酚酞外可能不止一种 | |
| B. | 恰好变为无色时溶液的PH一定等于7 | |
| C. | 原氢氧化钠溶液的PH大于10 | |
| D. | 不能使酚酞变红的溶液一定不是显碱性 |
查看答案和解析>>
科目: 来源: 题型:解答题
 兴趣小组同学对“氢氧化钠溶液与稀硫酸混合是否发生了化学反应”进行了如下探究:
兴趣小组同学对“氢氧化钠溶液与稀硫酸混合是否发生了化学反应”进行了如下探究:| 实验操作 | 实验现象 | |
| 甲同学 | 在盛有10mL一定浓度的氢氧化钠溶液的烧杯中,用胶头滴管慢慢滴入1-2滴稀硫酸,振荡,同时测定溶液的pH | 溶液pH减小但仍大于7 |
| 乙同学 | 在盛有10 mL一定浓度的氢氧化钠溶液的烧杯中,先滴入几滴无色酚酞溶液,然后再加入稀硫酸 | 溶液由红色变为无色 |
| 实验步骤 | 实验现象 | 结论 |
| 取少量碳酸钠固体于试管中滴加乙同学上述反应后的溶液于试管中 | 若有气泡生成 | 稀硫酸过量(“过量”或“不过量” |
| 若没有明显现象 | 稀硫酸与氢氧化钠溶液恰好完全反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
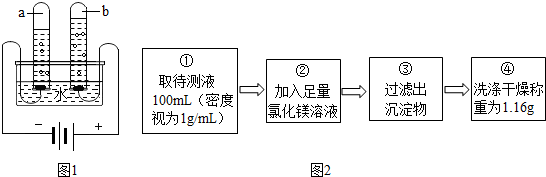
查看答案和解析>>
科目: 来源: 题型:解答题
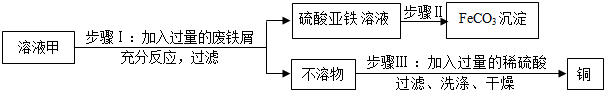
查看答案和解析>>
科目: 来源: 题型:解答题
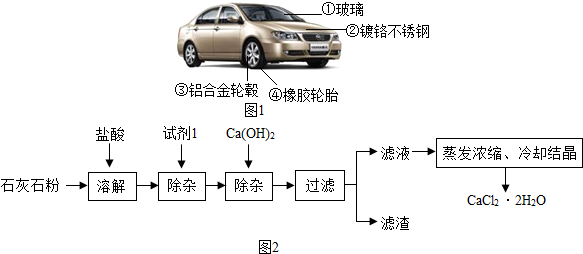
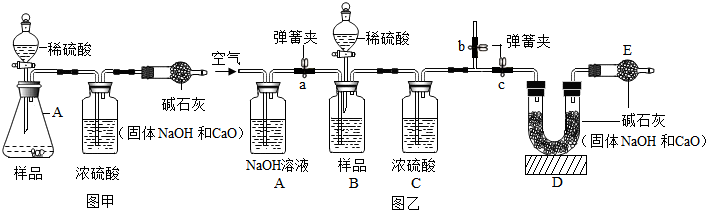
查看答案和解析>>
科目: 来源: 题型:选择题
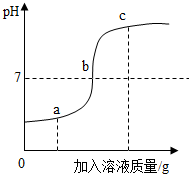 向20g溶质质量分数为3.65%的盐酸中逐滴加入NaOH溶液,得到的溶液pH变化图象如图所示.下列说法不正确的是( )
向20g溶质质量分数为3.65%的盐酸中逐滴加入NaOH溶液,得到的溶液pH变化图象如图所示.下列说法不正确的是( )| A. | a点对应的溶液中的溶质是NaCl和HCl | |
| B. | b点对应的溶液中Na+和Cl-的数目相等 | |
| C. | c点对应的溶液中Cl-的质量为0.71克 | |
| D. | 反应过程中生成NaCl的质量始终等于参加反应的HCl和NaOH的质量总和 |
查看答案和解析>>
科目: 来源: 题型:多选题
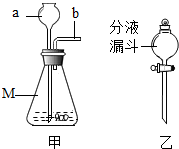 如图中的甲装置可作为实验室制二氧化碳的发生装置,下列说法正确的是( )
如图中的甲装置可作为实验室制二氧化碳的发生装置,下列说法正确的是( )| A. | M所指仪器的名称是广口瓶 | |
| B. | 仪器a、b插入双孔橡皮塞的先后顺序是先a后b | |
| C. | 甲装置也可以用作实验室制氧气和氢气的发生装置 | |
| D. | 将甲中a换成仪器乙,优点是能控制反应的发生与停止 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com