
科目: 来源: 题型:填空题
| 实验步骤 | 实验现象 | 分析与结论 |
| ①在盛有少量蒸馏水的烧杯中滴入2~3滴石蕊试液 | 液体显紫色 | 结论: 蒸馏水不能使酚酞变红 |
| ②在步骤①的烧杯中再滴加浓盐酸 | 试液变红 | 结论: 酸性溶液能使紫色石蕊试液变红 |
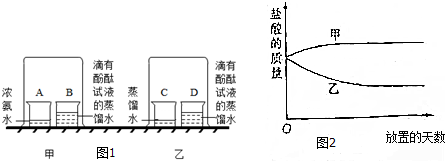
| ③按图甲所示进行实验 | 烧杯B中试液变红 | 原因: 由于浓盐酸具有较强的挥发性,所以倒扣的烧杯中会有大量的氯化氢分子存在,这些氯化氢的分子溶于烧杯B中会使该溶液变为稀盐酸而呈酸性,所以烧杯B中的紫色石蕊会变为红色,结论: 分子是不断运动的 |

查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 分析与结论 |
| ①在盛有少量蒸馏水的烧杯中滴入2~3滴石蕊试液 | 液体显紫色 | 结论:蒸馏水不能使酚酞变红 |
| ②在步骤①的烧杯中再滴加浓盐酸 | 试液变红 | 结论:酸性溶液能使紫色石蕊试液变红 |
| ③按图甲所示进行实验 | 烧杯B中试液变红 | 原因:由于浓盐酸具有较强的挥发性,所以倒扣的烧杯中会有大量的氯化氢分子存在,这些氯化氢的分子溶于烧杯B中会使该溶液变为稀盐酸而呈酸性,所以烧杯B中的紫色石蕊会变为红色, 结论:分子是不断运动的 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
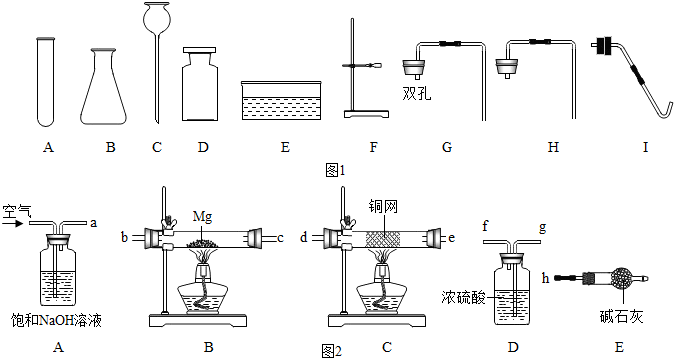
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量溶液于试管中,向溶液中滴加 过量的氯化钙溶液溶液,并不断振荡. | 白色沉淀产生 | 该溶液部分变质,含有 碳酸钠和氢氧化钠. |
| (2)将步骤(1)反应后的混合物静置,取少量上层清液,滴加2~3滴酚酞试液. | ,溶液变红色 |
| 温度(℃) | 10 | 20 | 40 | 60 | 80 | 100 |
| 溶解度(g/100g水) | 64 | 85 | 138 | 203 | 285 | 376 |

查看答案和解析>>
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:填空题
 电动车的使用不仅符合“低碳生活,绿色出行”的理念,同时电动车的体积小、重量轻、可以很方便地串街走巷,越来越受到人们的青睐,如图是一款电动车的示意图,请回答下列问题.
电动车的使用不仅符合“低碳生活,绿色出行”的理念,同时电动车的体积小、重量轻、可以很方便地串街走巷,越来越受到人们的青睐,如图是一款电动车的示意图,请回答下列问题.查看答案和解析>>
科目: 来源: 题型:填空题
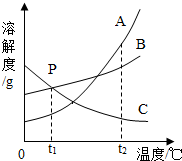 如图是A、B、C三种固体物质的溶解度曲线图.
如图是A、B、C三种固体物质的溶解度曲线图.查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 事实 | 解释 |
| A | 10mL酒精和10mL水混合体积小于20mL | 分子之间有间隔 |
| B | 稀硫酸和稀盐酸化学性质相似也存在差异 | 溶液中都含有H+、也存在不同的SO42-、Cl-离子 |
| C | F Cl Cl F、Cl原子化学性质相似 | 化学反应中都易得到1个电子 |
| D | 蜡烛燃烧生成CO2和H2O | 蜡烛组成里含有碳、氢、氧元素 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验步骤 | 反应后铜的质量 | 反应后溶液的质量 | 初步结论 |
| 精确称量mg铜丝,然后放进ng氯化铁溶液中 | 小于mg(填大于、小于或等于) | 大于ng(填大于、小于或等于) | 铜能与氯化铁溶液发生反应 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
 铝是目前人们在生产、生活中使用较多的一种金属.
铝是目前人们在生产、生活中使用较多的一种金属.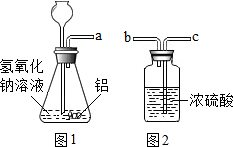
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com