
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 浓硫酸可用来干燥H2、CO2、NH3 等气体 | |
| B. | 不能直接品尝实验室药品的味道 | |
| C. | 误食重金属盐,可服牛奶或鸡蛋清解毒 | |
| D. | 液化气起火,迅速关闭阀门,以断绝可燃物的来源 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 视黄醇属于有机高分子化合物 | |
| B. | 视黄醇中含有20个碳原子、30个氢原子、1个氧原子 | |
| C. | 视黄醇中碳氢元素的质量比为2:3 | |
| D. | 视黄醇中氢元素的质量分数约为10.5% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 锂具有良好的导电性 | B. | 锂不能与盐酸反应 | ||
| C. | 锂是金属元素 | D. | 锂原子核外有3个电子 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
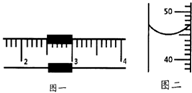 实验室需配制一定溶质质量分数的氯化钠溶液.
实验室需配制一定溶质质量分数的氯化钠溶液.查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:实验探究题
| 抗胃酸药 | 复方氢氧化镁片剂 | 铝碳酸镁片 |
| 有效成分 | Mg (OH)2 | AlMg(OH)3CO3 |
| 构成微粒 | Mg2+、OH- | A13+、Mg2+、OH-、CO32- |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com