
科目: 来源: 题型:实验探究题
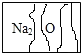 实验室有了瓶标签受到腐蚀(如图所示)的无色溶液,各学习小组开展探究.
实验室有了瓶标签受到腐蚀(如图所示)的无色溶液,各学习小组开展探究.| 实验操作 | 实验现象 |
| ①取少量该无色溶液于试管中,慢慢滴加BaCl2溶液 ②静置后,再去上层清液,向沉淀中滴加稀盐酸 | 产生白色沉淀 产生大量气泡,沉淀消失 |
| 实验操作 | 实验现象 |
查看答案和解析>>
科目: 来源: 题型:填空题
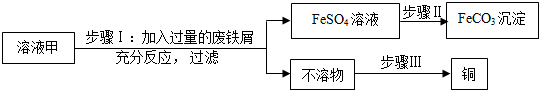
查看答案和解析>>
科目: 来源: 题型:实验探究题
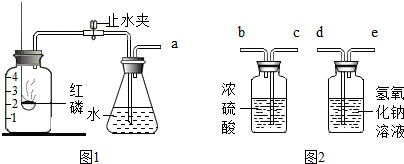
查看答案和解析>>
科目: 来源: 题型:推断题
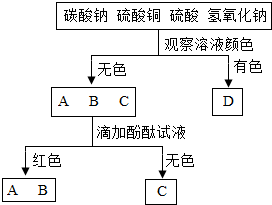 有四种常见的酸、碱或盐的溶液,用图所示的化学分析方法鉴别它们:
有四种常见的酸、碱或盐的溶液,用图所示的化学分析方法鉴别它们:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:推断题
| 实验步骤 | 实验现象 |
| ①取一定量的合金粉末,加入过量的氢氧化钠溶液,充分反应后过滤,滤纸上剩余物备用 | 粉末部分溶解,并有无色体放出 |
| ②取步骤①所得固体物质,加入过量的稀硫酸,充分反应 | 固体物质部分溶解,并有无色气体放出,溶液呈浅绿色 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 数据 | 实验1 | 实验2 | 实验3 | 实验4 | 实验5 |
| 加入稀盐酸的质量/g | 0 | 50 | 50 | 50 | 50 |
| 烧杯与烧杯中物质的总质量/g | 70.00 | 117.5 | 165.0 | M | 263.4 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
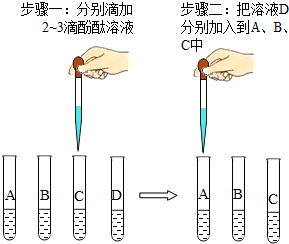 在实验台上有四瓶未贴标签的溶液,已知分別是碳酸钾溶液、氯化钠溶液、氯化钡溶液和稀硫酸.为了鉴别这四种溶液,在老师的指导下,兴趣小组的同学把这四种溶液按A、B、C、D进行编号,分别各取适量作为样品加入到四支试管中,进行了如图所示的探究活动:
在实验台上有四瓶未贴标签的溶液,已知分別是碳酸钾溶液、氯化钠溶液、氯化钡溶液和稀硫酸.为了鉴别这四种溶液,在老师的指导下,兴趣小组的同学把这四种溶液按A、B、C、D进行编号,分别各取适量作为样品加入到四支试管中,进行了如图所示的探究活动:查看答案和解析>>
科目: 来源: 题型:实验探究题
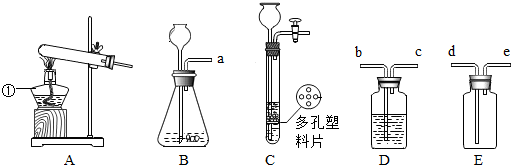
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com