
科目: 来源: 题型:实验探究题
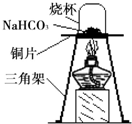 碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 需要鉴别的物质 | 方法和所加的试剂 | |
| 方法一 | 方法二 | ||
| A | 稀盐酸和氢氧化钠溶液 | 用PH试纸检验 | 加入硫酸铜溶液 |
| B | 碳酸钙和硫酸钡 | 加入足量水 | 加入盐酸 |
| C | 稀盐酸和稀硫酸 | 滴加紫色石蕊溶液 | 滴加氯化钡溶液 |
| D | 硫酸铵和食盐 | 观察颜色 | 加入足量水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若三支试管中都出现白色沉淀时,则最后加入的是硝酸银溶液 | |
| B. | 若三支试管中的观象分别为产生气泡、白色沉淀、无明显变化,则最后加的是稀盐酸 | |
| C. | 若两支试管中出现气泡,一支试管中出现白色沉淀时,则最后加入的是碳酸钠溶液 | |
| D. | 若两支试管中出现白色沉淀,一支试管中无明显变化时,则最后加入的是氯化钡溶液 |
查看答案和解析>>
科目: 来源: 题型:实验探究题

| 实验操作 | 实验现象 |
| 向两只盛有二氧化碳气体的软塑料瓶各加入三分之一体积的水,一只静置,一只充分震荡,观察现象 | 前者无明显变化,后者瓶子变瘪 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验序号 | 滴加CuSO4溶液的量 | 实验现象 |
| ① | 第1~6滴 | 有蓝色沉淀,但振荡后沉淀消失,形成亮蓝色溶液 |
| ② | 第7~9滴 | 产生蓝色沉淀,且沉淀逐渐增多,振荡后沉淀不消失,很快沉淀逐渐变黑色 |
| 实验序号 | 实验方法与操作 | 实验现象 | 结论 |
| ③ | 将少许Cu(OH)2粉末加到5mL蒸馏水中,充分振荡 | 沉淀不溶解,液体仍为无色 | 猜想一错误 |
| ④ | 将少许Cu(OH)2粉末加入到足量氢氧化钠浓溶液中,充分振荡,固体溶解 | 溶液呈亮蓝色 | 猜想二正确 |
查看答案和解析>>
科目: 来源: 题型:推断题

查看答案和解析>>
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验探究题
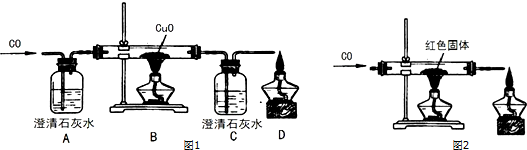
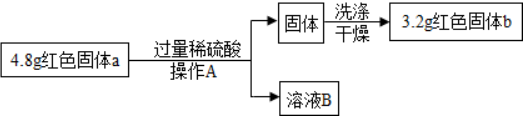
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com