
科目: 来源: 题型:实验探究题

| 实验序号 | 实验操作 | 实验现象 | 解释及结论 |
| 实验I | 用砂纸擦去镁条表面氧化膜,将其放入盛有适量饱和碳酸氢钠溶液的试管中 | 迅速反应,产生大量气泡和白色不溶物N | / |
| 实验Ⅱ | 将实M气体点燃,并在火焰上方罩一干、冷的小烧杯 | 气体安静燃烧、产生淡蓝色火焰,烧杯内壁有水雾出现 | 气体M是H2,燃烧的化学方程式为 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O |
查看答案和解析>>
科目: 来源: 题型:实验探究题
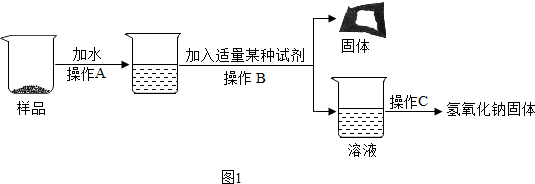
查看答案和解析>>
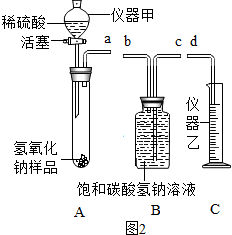
科目: 来源: 题型:实验探究题
查看答案和解析>>
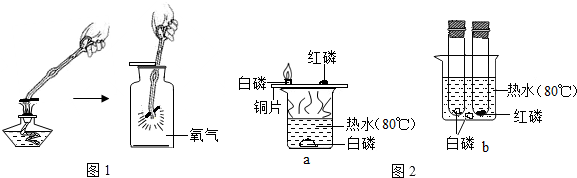
科目: 来源: 题型:实验探究题
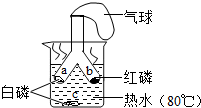 如图所示为探究燃烧条件的实验方案.将白磷和红磷分装于Y形管的两支管中,管口牢系小气球,将两支管同时深入热水中.
如图所示为探究燃烧条件的实验方案.将白磷和红磷分装于Y形管的两支管中,管口牢系小气球,将两支管同时深入热水中.查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com