
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:实验探究题
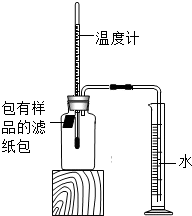 某实验小组对铁的锈蚀进行如下实验.室温时,将包有样品(足量)的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图.观察到量筒内水沿导管慢慢进入广口瓶(容积150mL).当温度恢复至室温,且量筒内水面高度不变时读数.记录起始和最终量筒的读数以及所需时间,如表:
某实验小组对铁的锈蚀进行如下实验.室温时,将包有样品(足量)的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图.观察到量筒内水沿导管慢慢进入广口瓶(容积150mL).当温度恢复至室温,且量筒内水面高度不变时读数.记录起始和最终量筒的读数以及所需时间,如表:| 序号 | 样品 | 量筒起始读数/mL | 量筒最终读数/mL | 所需时间/min |
| ① | 1g铁粉、0.2g碳和10滴水 | 100 | 70 | 约120 |
| ② | 1g铁粉、0.2g碳和10滴水和少量NaCl | 100 | 70 | 约70 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
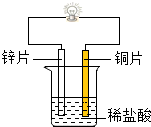 为探究锌、铜、镍三种金属的性质,某兴趣小组进行如下实验,请回答相应问题:
为探究锌、铜、镍三种金属的性质,某兴趣小组进行如下实验,请回答相应问题:| 锌 | 铜 | 镍 | 铜 | |
| 稀盐酸的质量分数 | 3% | 3% | 15% | 15% |
| 反应现象 | 少量气泡 | 无现象 | 许多气泡 | 无现象 |
查看答案和解析>>
科目: 来源: 题型:实验探究题

查看答案和解析>>
科目: 来源: 题型:实验探究题
| 方案编号 | 方案1 | 方案2 | 方案3 |
| 实验操作(分别取少量甲实验后的溶液于试管中) | 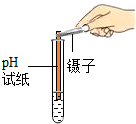 | 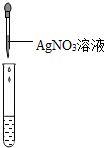 | 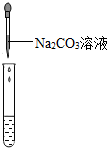 |
| 实验现象 | 对比标准比色卡:pH<7 | 产生白色沉淀 | |
| 实验结论 | 溶液中有HCl | 溶液中有CaCl2 |
| 要分离的盐 | 所用试剂 | 主要操作 |
| CaCl2、NaCl | Na2CO3,HCl | 混合物中加入Na2CO3溶液至不再产生沉淀,过滤,将滤液蒸发即得NaCl;将过滤后的固体加稀盐酸至不再产生气体,对溶液加热蒸发即得CaCl2 |

查看答案和解析>>
科目: 来源: 题型:实验探究题

| 实验操作 | 实验现象 | 实验结论 |
| ①按上图组装仪器,装入药品. ②加热铜锈,直至不再有气体产生,停止加热. | 绿色固体变为黑色;硫酸铜粉末变为蓝色;烧杯中液体变浑浊. | 加热铜锈生成的物质有氧化铜、水和二氧化碳;铜锈由铜、碳、氢、氧元素组成;烧杯中发生反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O. |
| ③冷却后,向试管中固体加入适量稀硫酸,稍加热. | 黑色固体溶解,溶液变为蓝色. |
| 序号 | 实验内容 | 实验结论 | 实验反思 |
| 实验1 | 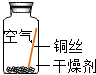 | 在干燥环境中,铜不易生锈. | (1)实验2和3中使用的是经煮沸后迅速冷却的蒸馏水,其原因是除去水中溶解的氧气. (2)如果要证明铜生锈的快慢是否与二氧化碳的浓度有关,还需要补充的一个实验内容是在含量高的二氧化碳的空气中,将铜丝放入蒸馏水中. |
| 实验2 | 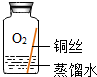 | 在没有二氧化碳的情况下,铜不易生锈. | |
| 实验3 | 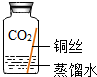 | 在没有氧气的情况下,铜不易生锈. | |
| 实验4 | 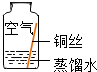 | 铜生锈的条件是铜与水、氧气、二氧化碳等物质充分接触. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com