
科目: 来源: 题型:选择题
 如图是甲、乙、丙三种物质的溶解度曲线,下列说法中正确的是 )
如图是甲、乙、丙三种物质的溶解度曲线,下列说法中正确的是 )| A. | P点表示甲、丙两种物质的饱和溶液质量相等 | |
| B. | t1℃时,乙物质的饱和溶液,升温至t2℃时仍是饱和溶液 | |
| C. | t1℃时,甲物质的饱和溶液中溶质和溶剂的质量比为1:4 | |
| D. | 将三种物质的溶液从t2℃降至t1℃,析出晶体最多的是甲物质 |
查看答案和解析>>
科目: 来源: 题型:解答题
 某化学兴趣小组对胃药“碳酸氢钠片”进行了探究,具体做法如下:
某化学兴趣小组对胃药“碳酸氢钠片”进行了探究,具体做法如下:查看答案和解析>>
科目: 来源: 题型:实验探究题
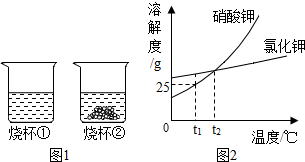 t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示.
t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示.查看答案和解析>>
科目: 来源: 题型:填空题
 该元素的原子结构示意图如图所示.
该元素的原子结构示意图如图所示.查看答案和解析>>
科目: 来源: 题型:实验探究题
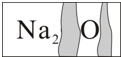 实验室有一瓶标签受到腐蚀的无色溶液,如图所示.这瓶无色溶液是放在存放盐溶液的柜子里.化学兴趣小组开展探究:
实验室有一瓶标签受到腐蚀的无色溶液,如图所示.这瓶无色溶液是放在存放盐溶液的柜子里.化学兴趣小组开展探究:| 实验操作 | 实验现象 |
| ①取少重该无色溶液于试管中,慢慢滴加BaCl2溶液 ②静置后,向沉淀中滴加稀盐酸 | 产生白色沉淀 产生大量气泡,沉淀全部溶解. |
| 实验操作 | 实验现象 |
| 取上述无色溶液少许于试管中,滴加少量的稀盐酸 | 溶液中没有气泡产生(或有气泡产生),该瓶无色溶液是硫酸钠溶液(或碳酸钠溶液) |
查看答案和解析>>
科目: 来源: 题型:实验探究题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:推断题

查看答案和解析>>
科目: 来源: 题型:实验探究题
| 温度/℃ | 10 | 20 | 30 | 40 |
| 溶解度/g | 0.244 | 0.255 | 0.264 | 0.265 |
| 试管编号 | 1 | 2 | 3 | 4 | 5 |
| 硫酸浓度(%) | 15 | 20 | 25 | 30 | 35 |
| 气体体积/mL | 35 | 47 | 55 | 51 | 42 |
| 试管编号 | A | B | C | D | E |
| 温度/℃ | 40 | 50 | 60 | 70 | 80 |
| 现象和 比较 | 有少量气泡 | 气泡比A号试管多 | 气泡明显比B号试管多 | 大量气泡产生,与常温用盐酸反应相似 | 反应非常激烈,迅速产生大量气体 |
查看答案和解析>>
科目: 来源: 题型:解答题
 新材料的出现促进了社会的进步,晶体硅是信息是被重要的材料.工业上生产高纯硅有以下两个重要环节;
新材料的出现促进了社会的进步,晶体硅是信息是被重要的材料.工业上生产高纯硅有以下两个重要环节;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com