
科目: 来源: 题型:实验探究题
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:推断题
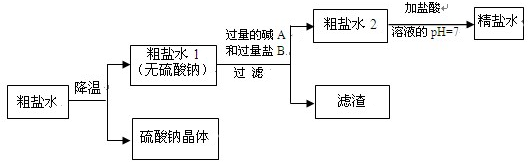
 已知A 与B、甲与乙均为初中化学常见的物质,且下列三种情况中的A 为甲烷、稀硫酸、硝酸银中的一种,其转化关系如图所示.
已知A 与B、甲与乙均为初中化学常见的物质,且下列三种情况中的A 为甲烷、稀硫酸、硝酸银中的一种,其转化关系如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 实验操作 | 实验现象及结论 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 10 | 20 | 30 | 40 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
| 碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |

查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 10℃时,甲、乙两种物质的饱和溶液浓度相同 | |
| B. | 保持 20℃,蒸发溶剂可使接近饱和的乙溶液变成饱和溶液 | |
| C. | 30℃时,将 40g 甲物质加人 50g 水中,充分溶解后溶液的质量为 80g | |
| D. | 10℃时,将两种饱和溶液升温至 30℃,溶液中溶质的质量分数都增大 |
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在加压条件下,6000L 氧气可装入容积为 40L 的钢瓶中,由此推断氧气分子变小了 | |
| B. | 蔗糖在热水中的溶解速度更快,由此推断在受热情况下分子运动速率加快 | |
| C. | 中和反应生成盐和水,由此推断生成盐和水的反应一定是中和反应 | |
| D. | 碱能使酚酞试液变红,由此推断能使酚酞试液变红的物质一定是碱 |
查看答案和解析>>
科目: 来源: 题型:实验探究题
| 反应时间/s | 20 | 40 | 60 | 80 | 100 |
| 烧杯和药品质量/g | 137.8 | 135.6 | m | 134.5 | 134.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com